Homocysteínový konsenzus
Homocysteine consensus
Homocysteine consensus reflects current knowledge that homocysteine is rather a risk marker then a factor and treatment of hyperhomocysteinemia does not reduce cardiovascular morbidity and mortality. Panel of experts state this position to approach cardiovascular prevention and treatment in praxis.
A. General therapeutic intervention is not generally indicated based on current EBM data.
B. General screening of homocysteine is not clinically beneficial in both general population and in patients with cardiovascular disease.
- Preventive administration of B group vitamins to reduce plasma homocysteine level in general population is not supported based on current EBM data. Population screening is not indicated – class III, level A.
- Therapeutic administration of B group vitamins to reduce plasma homocysteine level in patients in secondary or tertiary prevention is not supported based on current EBM data. Population screening is not indicated – class III, level A.
- There are no sufficient data on effect of measuring homocysteine on decision to start treating hypertension or dyslipidemias. Population screening is not indicated, only individual patients´ examination – class IIb, level A.
Keywords:
screening – cardiovascular prevention – homocysteine – vitamins group B
Autoři:
Ján Lietava 1; Pavel Blažíček 2; Martin Čaprnda 1; Katarína Rašlová 3; Jana Tisoňová 4; Branislav Vohnout 3,5,6
Působiště autorů:
I. interná klinika LF UK a UNB, Nemocnica Staré Mesto, Bratislava
1; Ústav chémie, klinickej biochémie a laboratórnej medicíny LF SZU v Bratislave
2; Koordinačné centrum pre familiárne hyperlipoproteinémie, SZU v Bratislave
3; Ústav farmakológie a klinickej farmakológie LF UK, Bratislava
4; Ústav výživy, FOaZOŠ SZU v Bratislave
5; Ústav epidemiológie LF UK v Bratislave
6
Vyšlo v časopise:
AtheroRev 2020; 5(1): 8-15
Kategorie:
Doporučené postupy
Souhrn
Homocysteínový konsenzus odráža súčasné poznanie, že homocysteín (HCY) je pravdepodobnejšie rizikový marker ako faktor a paušálna liečba hyperhomocysteínémie neprináša očakávané zníženie morbidity a mortality kardiovaskulárnych ochorení. Panel odborníkov zastáva nasledujúce stanovisko do praxe pre liečbu a prevenciu kardiovaskulárnych ochorení:
A. Paušálna terapeutická intervencia podľa súčasných poznatkov EBM nie je paušálne indikovaná.
B. Paušálny skríning homocysteínu neprináša klinický prínos pre všeobecnú populáciu ani pre pacientov s kardiovaskulárnymi ochoreniami.
- Preventívne podávanie multivitamínov skupiny B pre zníženie hladiny homocysteínu podľa doterajších vedomostí založených na EBM vo všeobecnej populácii nemá podporu. Populačný skríning nie je indikovaný – trieda odporučení III, úroveň dôkazov IA.
- Terapeutické podávanie multivitamínov skupiny B pre zníženie hladiny homocysteínu podľa doterajších vedomostí založených na EBM v populácii pacientov v sekundárnej i terciárnej prevencii nemá význam. Populačný skríning nie je indikovaný – trieda odporučení III, úroveň dôkazov A.
- Nebol dostatočne preskúmaný prínos stanovenia HCY pri rozhodovaní o začatí antihypertenzívnej alebo hypolipidemickej liečby. Populačný skríning nie je indikovaný, iba vyšetrenie u individuálneho pacienta – trieda odporučení IIb, úroveň dôkazov A.
Klíčová slova:
homocysteín – kardiovaskulárna prevencia – skríning – vitamíny skupiny B
Preambula
Homocysteínový konsenzus (HK) z roku 2003 [1] odrážal konsenzuálny názor, že hyperhomocysteínémia (hyperHCY) by mohla byť rizikovým faktorom aterosklerózy, ktorý vypĺňa priestor v stanovení celkového rizika život ohrozujúcich kardiovaskulárnych (KV) príhod nevysvetlený klasickými rizikovými faktormi ako je fajčenie, hypertenzia, dyslipidémia, diabetes mellitus. Pri absencii intervenčných klinických štúdii ovplyvňujúcich hladiny homocysteínu (HCY) sa HK z roku 2003 zakladal na úrovni IIb – a nešpecifikoval, či je homocysteín rizikový faktor alebo rizikový marker. Slovenský HK 2003 bol analogický odporučeniam iných európskych krajín, ako bol Konsenzus DACH (Nemecko, Rakúsko, Švajčiarsko), alebo odporúčaniam viacerých odborných spoločností v USA a Japonsku [2–8].
Ukončenie veľkých klinických intervenčných štúdií výrazne zlepšilo jednak chápanie významu hyperHCY pre etiopatogenézu aterosklerózy, jednak spochybnilo potrebu liečby.
Nový Homocysteínový konsenzus 2020 (HK 2020) odráža súčasné poznanie, že hyperHCY je skôr rizikový marker ako faktor a paušálna liečba hyperHCY neprináša predpokladané zníženie morbidity a mortality kardiovaskulárnych ochorení. Preto ani paušalny skríning homocysteínu neprináša klinický prínos pre všeobecnú populáciu ani pre pecientov s kardiovaskulárnymi ochoreniami.
Zároveň na základe medicíny založenej na dôkazoch (Evidence Based Medicine – EBM) predložený HK 2020 upresňuje diagnózy alebo stavy v kardiológii, pri ktorých stanovenie HCY môže priniesť klinický efekt.
Úvod
Vysoko zvýšené hladiny homocysteínu ≥ 100 μmol/l, spôsobujúce až homocystínúriu, sú prítomné u ťažkých malnutričných stavov alebo deficiencií vitamínov B6, B12 a kyseliny listovej, ako aj u vrodených enzymatických defektov. Tieto stavy sú spojené s ťažkými orgánovými abnormalitami, ako sú okulárne lézie (ectopia lentis), osteoporóza, poruchy CNS (mentálna retardácia, psychické abnormality), vaskulárne postihnutia (najmä tromboembolické príhody) a v HK 2020 nie sú hodnotené.
Naproti tomu mierne zvýšené hladiny HCY (mierna hyperHCY bola definovaná ako koncentrácia 15–30 μmol/l HCY v plazme) sú spojené s kardiovaskulárnymi ochoreniami, vrátane ischemickej choroby srdca, cerebrovaskulárnych ochorenií a ischemickej choroby dolných končatín.
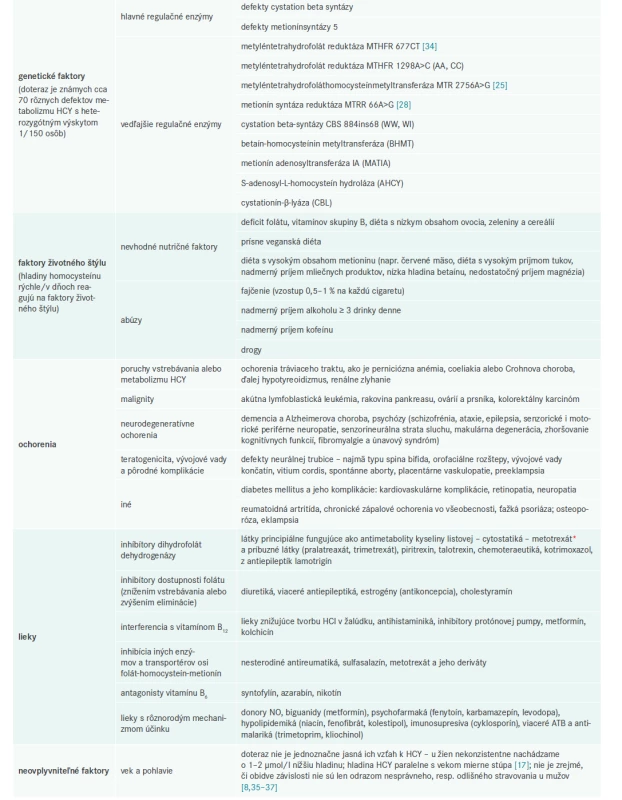
Z populačného hľadiska je mierna hyperhomocysteinémia významnejšia ako vysoká, pretože má vyššiu prevalenciu a na rozdiel od vysokej je asymptomatická [9]. Príčiny miernej hyperhomocysteinémie možno rozdeliť na genetické a ostatné. Genetické poruchy sa môžu vyskytovať jednak v homozygotnej forme, vtedy sú však príčinou ťažkého klinického syndrómu – homocysteínúrie, v heterozygotnej forme sa jedná hlavne o mutáciu génu pre 5,10-metyléntetrahydrofolát reduktázu, ktorá asociuje s inými faktormi, ako je nedostatočný príjem kyseliny listovej, vitamínov B6 a B12, renálna insuficiencia alebo nefropatia, lieková toxicita (tab. 1).
Liečba miernej hyperhomocysteínémie neprináša klinický benefit pre pacientov.
Vymedzenie rámca homocysteínového konsenzu 2020
- Homocysteínový konsenzus 2020 sa týka pacientov s kardiovaskulárnymi ochoreniami (vznik, progresia a rekurencia ischemickej choroby srdca, fatálne i nefatálne infarkty myokardu, chronické srdcové zlyhanie, ischemická choroba dolných končatín, disekcia aorty, venózne trombózy a tromboembolické príhody, fatálna aj nefatálna náhla cievna mozgová príhoda, artériová hypertenzia, celková kardiovaskulárna mortalita).
- Homocysteínový konsenzus 2020 pojednáva o ľahkej a stredne závažnej hyperhomocysteínémii (15–99 µmol/l) bez ohľadu na pôvod (nutrične, epigeneticky, geneticky – platí pre heterozygotickú formu – podmienenú hyperHCY).
- Homocysteínový konsenzus 2020 využíva princípy EBM a odporúčania sú hodnotené ako trieda odporučení I-III a úroveň dôkazov A-C.
Význam homocysteínu
Homocysteín je sulfhydrylová aminokyselina obsahujúca síru a je intermediárnym metabolitom metionínu. HCY objavil nositeľ Nobelovej ceny de Vigneaud v roku 1934. V roku 1962 bola opísaná vrodená hyperHCY u mentálne retardovaných detí, pričom ďalšie práce ukázali okrem iného postihnutia aj výskyt arteriálnej aj venóznej trombózy [10,11]. Až roku 1989 sa zistilo, že už mierne zvýšená koncentrácia homocysteínu v krvi je úzko spätá s výskytom predčasnej aterosklerózy a recidivujúcich tromboembólií [12,13].
V 90. rokoch minulého storočia vzniká tzv. homocysteínová teória aterosklerózy založená na početných experimentálnych a observačných štúdiách, ktoré nachádzali hyperHCY v takmer všetkých metabolických cestách potencujúcich aterosklerotický proces. Experimentálne a humánne štúdie dokumentujú, že akútna hyperHCY navodená zvýšenou hladinou metionínu indukuje endoteliálnu dysfunkciu, akceleruje progresiu aterosklerotického plátu a podporuje protrombogénny stav [14].
HCY multifaktoriálne zhoršuje funkciu endotelu cestou oxidácie lipoproteínov s nízkou denzitou [15], zvýšením adhézie monocytov na cievnu stenu, zvýšeným spätným vychytávaním lipidov a ich uskladnením v stene cievy, aktiváciou zápalu, stimuláciou proliferácie hladkej svaloviny ciev, aktiváciou koagulačných faktorov a trombocytovou dysfunkciou [16].
Početné prierezové epidemiologické štúdie jednoznačne dokazujú, že zvýšená hladina HCY je priamoúmerne asociovaná so zvýšenou kardiovaskulárnou morbiditou a mortalitou rovnako u mužov a žien [17–19]. Hladiny homocysteínu sú vyššie u pacientov s dokázanou ischemickou chorobou srdca v porovnaní s klinicky zdravou populáciou. Podľa pôvodných odhadov sa HCY mal podieľať asi 10 % na celkovej úmrtnosti na kardiovaskulárne ochorenia ako sú infarkt myokardu alebo mozgová porážka. Vzostup homocysteínu o 5 μmol/l bol asociovaný so zvýšením rizika KV-príhod o 20 % [9].
Prevalencia hyperHCY je vo všeobecnej populácii cca 5 % a u pacientov s klinicky manifestnými prejavmi aterosklerózy sa pohybuje medzi 14–47 %. Na Slovensku prvé výsledky u pacientov s prekonaným IM publikovali Rašlová et al, ktorí zistili asi 30% výskyt, výsledky Lietavu et al potvrdzujú tieto vysoké hodnoty u pacientov s dokumentovanou ICHS, ako aj u bežnej populácie. Ďalšie štúdie potvrdili aj relatívne vysoké hladiny u rómskej populácie a u osôb s defektom génu pre C677T metyléntetrahydrofolát reduktázu HFR) [20–23]
HCY a aterosklerotické postihnutie cievneho systému je však stále kauzálne nejasné a vynára sa čoraz viacej publikácií, ktoré kauzalitu spochybňujú [16,24] a jedným z určujúcich faktorov sa javí nízka hladina folátov. Prospektívna štúdia Kuopio Ischemic Heart Disease Risk Factor demonštrovala, že nízke hladiny folátov predikovali výskyt KV-príhod nezávisle od hladín HCY [18,25].
Tzv. homocysteínová hypotéza bola zásadne spochybnená absenciou priameho dôkazu priaznivého efektu poklesu KV-mortality a morbidity po dietárnom alebo medikamentóznom znížení HCY [26].
Veľké prospektívne klinické štúdie (tab. 2) jednoznačne preukázali, že zníženie hladiny HCY nie je adekvátne spojené zo znížením mortality a morbidity a KV-ochorenia.
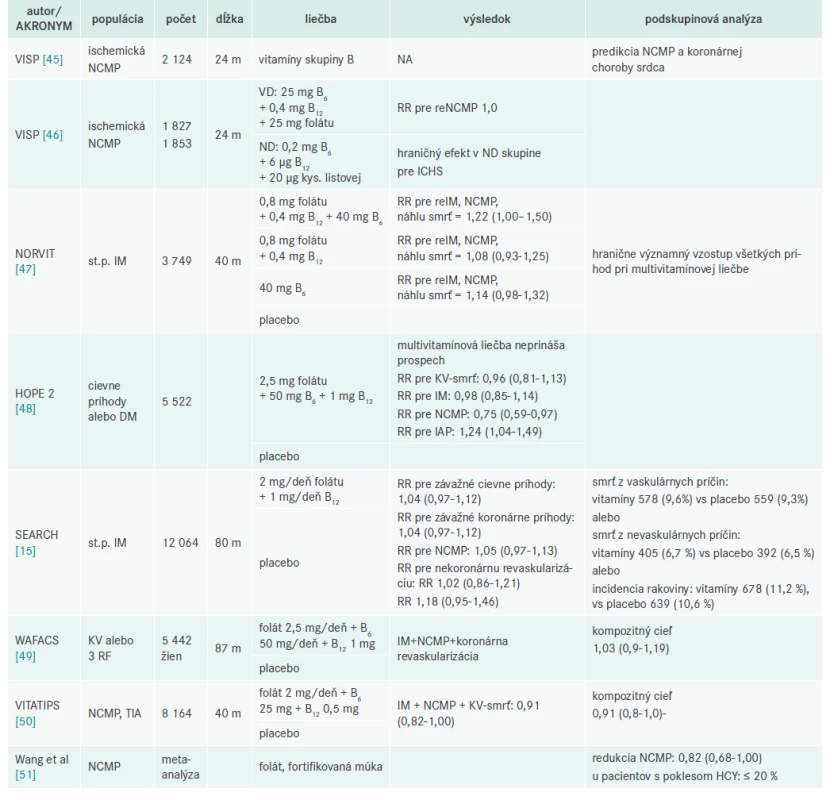
Komisia Spojených štátov pre prevenciu [27] publikovala v roku 2009 metaanalýzu vplyvu nových rizikových faktorov na koronárnu chorobu srdca a konštatovala, že ani jedna populačná prospektívna štúdia nedokázala prínos zníženia HCY na KV-príhody [27].
Odporučenia Japonskej aterosklerotickej spoločnosti pre diagnostiku a prevenciu aterosklerotických KV-ochorení zaraďujú homocysteín do skupiny rizikových markerov alebo faktorov hodných zváženia bez bližšej špecifikácie. Konštatujú, že existuje priamoúmerná asociácia hyperHCY s ICHS a NCMP ako aj so zvýšeným relatívnym rizikom pre IM, ale chýba efekt zníženia HCY na KV-mortalitu a morbiditu [28].
Je zrejmé, že vzťah medzi KV-ochoreniami a HCY je voľný a skreslený početnými interferujúcimi faktormi, ako je nízka hladina folátu, vitamínov B6 a B12, ako aj faktormi ovplyvňujúcimi vstrebávanie vitamínov v tráviacom trakte (napr. chronická antrumgastritída) a ich vylučovanie obličkami (napr. pri chronickej renálnej insuficiencii).
Hodnotenie postavenia homocysteínu pre prognózu pacienta však dosiaľ nie je definitívne.
Komisia Spojených štátov pre prevenciu poukázala aj na skutočnosť, že ak sa hyperHCY zakalkuluje do Framinghamského skórovacieho systému, potom každý vzostup Hcy o 5 μmol/l zvyšuje riziko KV-príhod o 9 % nezávisle od ostatných rizikových faktorov [27]. Analogickú retrospektívnu analýzu realizovali Veeranna aet al na populáciách zaradených do štúdii The Third National Health and Nutrition Examination Survey, (NHANES III – 6 797 osôb) a Multiethnic Study on Atherosclerosis (MESA – 6 814 osôb) [29] a opäť potvrdili prínos zvýšenej hladiny HCY pre identifikáciu osôb s vysokým rizikom – hladiny > 15 μmol/l viedli k reklasifikácii cca 15 % osôb vo všeobecnej populácií a cca 20 % osôb so stredne zvýšeným KV-rizikom. Paynterová a Cooková poukázali na modeli odvodenom z reprezentatívnej štúdie Women´s Health, že zakomponovanie homocysteínu do predikcie KV-rizika zvýši schopnosť identifikovať ohrozené osoby v skupine s intermediálnym rizikom, ale nie vo všeobecnej populácii [30].
Doteraz však platí, že neexistuje cielená štúdia, ktorá by sledovala efekt liečby HCY na reklasifikovanú populáciu so stredne zvýšeným rizikom [27].
Swiss Heart Study [31] sledovala potrebu reintervencie po úspešnej angioplastike u pacientov so signifikantnou stenózou koronárnych artérii. V randomizovanej dvojito slepej placebom kontrolovanej štúdii dokázali v intervenovanej skupine pokles potreby opakovanej intervencie. Masívna liečba znížila priemernú hladinu HCY na 7,5 μmol/l, čo sa nepodarilo iným štúdiám.
Holmesová et al vydali v roku 2011 odporúčania pre príjem folátu s ohľadom na prevenciu NCMP aj so zohľadnením MTHRF genotypu, kde konštatovali, že štúdie v krajinách s vysokým príjmom folátu nepreukázali prínos liečby zameranej na zníženie homocysteínu. Metaanalýza štúdií zohľadňujúcich varianty MTHRF-677C◊T ukázala, že zníženie HCY je asociované s výraznejším poklesom NCMP iba v krajinách s nízkymi hladinami folátu (RR 0,78; 95% CI 0,68–0,90), v krajinách s vysokými hladinami je prínos neistý (RR = 0,94; 95% CI 0,85–1,04). Suplementácia resp. liečba pacientov s genetickými variantmi nemala výraznejší vplyv na NCMP, ale panel upozorňoval na riziko biasu dané nízkym počtom sledovaných osôb [32,33].
Metabolizmus a determinanty hladín homocysteínu
Homocysteín je aminokyselina vznikajúca demetyláciou metionínu, ktorý sa prijíma v potrave vo forme živočíšnych bielkovín. K metabolizmu HCY sú potrebné kofaktory (folát, vitamíny B6 a B12), ktorých prítomnosť alebo nedostatok, či dokonca absencia, určujú cestu jeho odbúrania
- remetyláciou na metionín za prítomnosti kofaktorov folátu a kyanokobalamínu alebo
- trans-sulfuráciou na cysteín a jeho následné vylúčenie močom za účasti pyridoxínu
Zvýšená homocysteínémia môže byť podmienená rôznorodými faktormi, ktoré vytvárajú často protikladnú štruktúru mechanizmov, vedúcich k hyperHCY. Tab. 1 sumarizuje najčastejšie faktory.
Odber a meranie hladín homocysteínu
Hladiny HCY merané za štandardných podmienok nalačno majú vysokú reproducibilitu (rozdiely menej ako 7 %) a jednorazový odber má dostatočnú výpovednú hodnotu. Nutné je rýchle spracovanie odberu – za každú hodinu skladovania pri izbovej teplote stúpa hladina HCY o 10 %. Optimálny je odber do ľadu a rýchla analýza vzorky.
Stanovenie homocysteínu v moči pre hladiny definované v týchto odporučeniach nemá význam, pretože iba < 1 % HCY sa nachádza v moči po filtrácii v obličkách – klinicky relevantná homocysteínúria je prítomná u homozygotných foriem, ktorých sa HK 2020 netýka.
Výpovedná hodnota metionínového záťažového test oproti štandardnému odberu nalačno nebola definitívne určená. Vhodná je súčasná analýza jednotlivých kofaktorov metabolizmu (kyselina folová, vitamíny B6 a B12), ktorá poskytuje informácie o ceste odbúravania metionínu, resp. homocysteínu [11–14].
Analogicky ako u cholesterolu aj normálna hladina homocysteínu bola určená arbitrárne a tiež môžeme očakávať posun smerom nadol. Hladiny homocysteínu sú klasifikované nasledovne:
- normálna hladina < 15 μmol/l
- mierne zvýšená 15–30 μmol/l
- stredne zvýšená 30–100 μmol/l
- ťažká > 100 μmol/l
Vo viacerých intervenčných štúdiách a ich metaanalýzach boli arbitrárne použité hodnoty menej ako 6,3, resp. 8 μmol/l, ktoré boli asociované so signifikantnou redukciou KV-príhod [8,14,38].
Základnou metódou pre stanovenie plazmatických hladín homocysteínu je plynová chromatografia (HPLC), v posledných rokoch za však začínajú používať aj ďalšie metódy, ako je enzýmová imunoesej (EIA) – stanovenie, ktoré je podstatne lacnejšie a menej prácne. Pri porovnávaní jednotlivých metód HPLC aj špičkové pracoviská udávajú vysokú variabilitu jednak medzi použitými metódami a jednak pri opakovaných odberoch. Rozdiely medzi metódami i medzi dňami zvyčajne nepresahovali 10 %, ale vo výnimočných prípadoch boli konštatované až 5 mikromolové rozdiely [39]. Všeobecne platí, že HPLC vykazuje najvyššie namerané hodnoty HCY a EIA metóda poskytuje nižšie hodnoty aj pri dodržaní všetkých laboratórnych metodologických postupov [40].
Ďalšie používané metódy zahŕňajú kapilárnu elektroforézu, plynovú chromatografiu – hmotovú spektrografiu, imunoeseje. Vzhľadom na značné rozdiely medzi jednotlivými metódami je používať u individuálneho pacienta tú istú metódu pre posudzovanie dynamiky zmien hladiny HCY.
Liečba hyperhomocysteínémie
Závislosť hladiny HCY na nadmernom príjme živočíšnych bielkovín a nedostatočnom príjme ovocia a zeleniny, resp. kyseliny folovej, vitamínov B6 a B12 priamo predurčovala homocysteín ako ľahko ovplyvniteľný rizikový marker pre redukciu KV-príhod.
Výsledky intervenčných aj observačných štúdii ale potvrdzujú, že zvýšené hodnoty HCY asociujú s KV-ochoreniami, ale nepodporujú suplementáciu folátom vitamínom B12 alebo B6 za účelom redukcie KV-príhod a neprinášajú dôkazy o prospechu pre pacienta.
Určitý benefit možno očakávať u nízko folátovej populácie zo zvýšeným KV-rizikom, ale dôkazy sú iba na úrovni IIIC – jednotlivé prípadové štúdie.
Hodnotenie redukcie HCY nie je definitívne jasné – objavili sa analýzy naznačujúce, že viaceré intervenčné štúdie nedosiahli efektívne zníženie hladiny HCY < 6,3, resp. 8 μmol/l, resp. o 20 %, nezohľadňovali pacientov s normálnymi vstupnými hladinami HCY, pacientov zo zníženými renálnymi funkciami alebo zhoršeným vstrebávaním HCY, čím sa skreslil celkový účinok intervencie.
Napr. Flicker et al zistili, že v skupine 299 seniorov starších 75 rokov suplementácia vitamínmi B6, B12 a kyselinou folovou počas 2 rokov znižovania HCY u tých seniorov, ktorí mali pri vstupe do štúdie najväčší deficit daných vitamínov a najvyššie hladiny HCY [41].
Situáciu by mohli objasniť nové populačné štúdie s novým dizajnom, ktoré však neboli dosiaľ iniciované.
Odporúčania pre prax
Intervencia podľa súčasných poznatkov EBM nie je indikovaná a panel odborníkov zastáva nasledujúce stanovisko do praxe pre liečbu a prevenciu KV-ochorení.
- Preventívne podávanie multivitamínov pre zníženie hladiny HCY podľa doterajších vedomostí založených na EBM vo všeobecnej populácii nemá podporu. Populačný skríning nie je indikovaný.
trieda odporúčaní III, úroveň dôkazov A (tab. 3) - Terapeutické podávanie multivitamínov pre zníženie hladiny homocysteínu podľa doterajších vedomostí založených na EBM v populácii pacientov v sekundárnej i a terciárnej prevencii nemá význam. Populačný skríning nie je indikovaný.
trieda odporúčaní III, úroveň dôkazov A (tab. 3) - Nebol dostatočne preskúmaný prínos stanovenia HCY pri rozhodovaní o začatí antihypertenzívnej alebo hypolipidemickej liečby. Populačný skríning nie je indikovaný, iba vyšetrenie u individuálneho pacienta.
trieda odporúčaní IIb, úroveň dôkazov A (tab. 3)

U individuálnych pacientov podľa bodu 7 v HK 2020 je postup založený iba na individuálnom rozhodnutí lekára, ktorý uváži potrebu znížiť hladinu HCY a liečbu by mal riadiť nasledujúcimi zásadami:
- Úprava behaviorálnych faktorov (prestať fajčiť, v prípade potreby znížiť príjem alkoholu a kofeínu, obmedziť jedlá bohaté na metioním (najmä červené mäso) [42].
U pacienta so sedanterizmom alebo nadváhou zredukovať hmotnosť a zvýšiť fyzickú aktivitu podľa doterajších odporučení pre prevenciu KV-ochorení – dlhodobý vytrvalostný tréning znižuje hladiny HCY [43].
CAVE! Pri metaanalýze vplyvu záťaže na homocysteín, jednorazové aeróbne cvičenie zvyšuje hladiny HCY o 1,18 μmol/l (95% CI 0,71–1,65) a vytrvalostný tréning s nízkou až strednou intenzitou paradoxne až o 1,39 μmol/l (95% CI 0,9–1,89). Na druhej strane rezistentný tréning znižuje plazmatické koncentrácie homocysteínu o 1,53 μmol/l (95% CI 2,77–0,28) [34,44]. - Intervencia folátom a vitamínmi skupiny B má byť realizovaná až po stanovení deficitu jednotlivých vitamínov. Uprednostniť zmenu diéty na stravovacie návyky s vysokým obsahom chýbajúcich vitamínov pred paušálnou vitamínovou suplementáciou.
- Až po zlyhaní úpravy životosprávy je možné použiť vitamínovú suplementáciu v rozsahu dávkovania, ktoré bolo použité v prospektívnych štúdiách a znižovalo HCY (tab. 2) Pomerné dávkovanie jednotlivých vitamínov nebolo sledované a dávky sa pohybovali v nasledovnom rozsahu:
- ▪ kyselina folová 100–1000 μg/deň
- ▪ vitamín B12 2,4–5 μg/deň
- ▪ pyridoxín 10–20 mg/deň
Cave! V metaanalýze intervenčných štúdií s folátom, vitamínom B6 a B12 nevykazovalo podávanie B6 prídavný účinok na zníženie hladín sérového homocysteínu (folát znižoval o 25 % a pridanie vitaminu B12 o ďalších 7 %). Naviac v poslednom období je intenzívne diskutovaná otázka bezpečnosti podávania liekov a výživových doplnkov obsahujúcich vitamín B6 vo forme vitaméru pyridoxinu, ktorého chronické podávanie je spojené s rizikom senzorickej neuropatie až neuroxicity aj pri užívaní nízkych dávok (1,5 mg).
Dĺžka terapie ani jej preventívny účinok nie sú známe, bezpečnosť je overená na úrovni sledovania vedľajších účinkov a dĺžky trvania publikovaných randomizovaných klinických štúdií.
Málo početné a nedostatočne výpovedné štúdie poukazujú, že homocysteín sú schopné znížiť aj ďalšie farmakologicky účinné látky, resp. nutraceutiká: N-acetyl-cysteín (NAC), omega-3-mastné kyseliny, taurín, trimetylglycín (v minulosti nazývaný betaín), cholín, vitamín B2 (riboflavín). Ich dlhodobé používanie vo vzťahu k HCY nebolo dosiaľ sledované a nemôže byť zatiaľ ani odporučené.
doc. MUDr. Ján Lietava, CSc.
Doručeno do redakce 7. 12. 2019
Přijato po recenzi 6. 1. 2020
Zdroje
- Lietava J, Dukát A, Blažíček P et al. Návrh na homocysteínový konsenzus. Cardiol 2003; 12(3): K/C 42–46.
- Stanger O, Herrmann W, Pietrzik K et al. DACH-LIGA homocystein (german, austrian and swiss homocysteine society): consensus paper on the rational clinical use of homocysteine, folic acid and B-vitamins in cardiovascular and thrombotic diseases: guidelines and recommendations. Clin Chem Lab Med 2003; 41(11): 1392–1403.Dostupné z DOI: <http://dx.doi.org/10.1515/CCLM.2003.214>.
- Refsum H, Smith AD, Ueland PM et al. Facts and recommendations about total homocysteine determinations: an expert opinion. Clin Chem 2004; 50(1): 3–32. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2003.021634>.
- Stehouwer CD, van Guldener C. Does homocysteine cause hypertension? Clin Chem Lab Med 2003; 41(11): 1408–1411. Dostupné z DOI: <http://dx.doi.org/10.1515/CCLM.2003.216>.
- Chamberlain K. Homocysteine and cardiovascular disease: a review of current recommendations for screening and treatment. J Am Acad Nurse Pract 2005; 17(3): 90–95. Dostupné z DOI: <http://dx.doi.org/10.111/j.1041–2972.2005.0016.x>.
- Mosca L, Banka CL, Benjamin EJ et al. Evidence-based guidelines for cardiovascular disease prevention in women: 2007 update. J Am Coll Cardiol. 2007; 49(11): 1230–1250. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2007.02.020>.
- Teramoto T, Sasaki J, Ishibashi S et al. Cardiovascular disease risk factors other than dyslipidemia. Executive summary of the Japan Atherosclerosis Society (JAS) guidelines for the diagnosis and prevention of atherosclerotic cardiovascular diseases in Japan – 2012 version.. J Atheroscler Thromb 2013; 20(10): 733–742. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.17368>.
- Guilliams TG. Homocysteine – a risk factor for vascular diseases: Guidelines for the clinical practice. JANA 2004; 7(1): 11–21.
- Boushey CJ, Beresford SA, Omenn GS et al. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease: probable benefits of increasing folic acid intakes. JAMA 1995; 274(13): 1049–1057. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.1995.03530130055028>.
- Gerritsen T, Waisman HA. Homocystinuria, an error in the metabolism of methionine. Pediatrics 1964; 33 : 413–20.
- Carson NA, Neill D. Metabolic abnormalities detected in a survey of mentally backward individuals in Northern Ireland. Arch Dis Child 1962; 37 : 505–513. Dostupné z DOI: <http://dx.doi.org/10.1136/adc.37.195.505>.
- Ueland P, Refsum H. Plasma homocysteine, a risk factor for vascular disease: plasma levels in health, disease, and drug therapy. J Lab Clin Med 1989; 114(5): 473–501.
- Ueland P, Refsum H. Plasma homocysteine, a risk factor for premature vascular disease. Plasma levels in healthy persons; during pathologic conditions and drug therapy. Nord Med 1989; 104(11) :293–298.
- Bolander-Gouaille C. Focus on Homocysteine and the Vitamins Involved in its metabolism: Involved in Its Metabolism: Springer Science & Business Media: 2002. ISBN 978–2-8178–0845–1.
- Armitage J, Bowman L, Wallendszus K et al. [Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine (SEARCH) Collaborative Group]. Intensive lowering of LDL cholesterol with 80 mg versus 20 mg simvastatin daily in 12,064 survivors of myocardial infarction: a double-blind randomised trial. Lancet 2010; 376(9753): 1658–1669. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(10)60310–8>.
- Kaul S, Zadeh AA, Shah PK. Homocysteine hypothesis for atherothrombotic cardiovascular disease: not validated. J Am Coll Cardiol 2006; 48(5): 914–923. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2006.04.086>.
- Hankey GJ, Eikelboom JW. Homocysteine and vascular disease. Lancet 1999; 354(9176): 407–413. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(98)11058–9>.
- Voutilainen S, Lakka T, Porkkala-Sarataho E et al. Low serum folate concentrations are associated with an excess incidence of acute coronary events: the Kuopio Ischaemic Heart Disease Risk Factor Study. Eur J Clin Nutr 2000; 54(5): 424–428. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.ejcn.1600991>.
- Voutilainen S, Lakka T, Hämelahti P et al. Plasma total homocysteine concentration and the risk of acute coronary events: the Kuopio Ischaemic Heart Disease Risk Factor Studytpdel. J Intern Med 2000; 248(3): 217–222. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2796.2000.00741.x>.
- Gašparovič J, Rašlová K, Bašistová Z et al. Effect of C677T methylenetetrahydrofolate reductase gene polymorphism on plasma homocysteine levels in ethnic groups. Physiol Res 2004; 53(2): 215–218.
- Rašlová K, Smolková B, Vohnout B et al. Risk factors for atherosclerosis in survivors of myocardial infarction and their spouses: comparison to controls without personal and family history of atherosclerosis. Metabolism 2001; 50(1): 24–29. Dostupné z DOI: <http://dx.doi.org/10.1053/meta.2001.19499>.
- Lietava J, Dukát A, Kotrec M et al. Relationship of absolute risk of atherosclerosis to hyperhomocysteinemia in Slovak males after myocardial infarction. Atherosclerosis 2000; 151(1):107. Dostupné z DOI: <https://doi.org/10.1016/S0021–9150(00)80484–0>.
- Lietava J, Dukat A, Fodor G. Homocysteine Slovakia study: study design and occurrence of hyperhomocysteinaemia and other risk factors. Bratisl Lek Listy 2012; 113(2): 80–86.
- Smulders YM, Blom HJ. The homocysteine controversy. J Inherit Metab Dis 2011; 34(1): 93–99. Dostupné z DOI: <http://dx.doi.org/10.1007/s10545–010–9151–1>.
- Voutilainen S, Virtanen JK, Rissanen TH et al. Serum folate and homocysteine and the incidence of acute coronary events: the Kuopio Ischaemic Heart Disease Risk Factor Study. Am J Clin Nutr 2004; 80(2): 317–323. Dostupné z DOI: <http://dx.doi.org/10.1093/ajcn/80.2.317>.
- Martí‐Carvajal AJ, Sola I, Lathyris D et al. Homocysteine‐lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev 2017; 8: CD006612. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD006612.pub5>.
- Helfand M, Buckley DI, Freeman M et al. Emerging risk factors for coronary heart disease: a summary of systematic reviews conducted for the US Preventive Services Task Force. Ann Intern Med 2009; 151(7): 496–507.
- Teramoto T, Sasaki J, Ishibashi S et al. Executive summary of the Japan Atherosclerosis Society (JAS) guidelines for the diagnosis and prevention of atherosclerotic cardiovascular diseases in Japan—2012 version. J Atheroscler Thromb 2014; 21(4): 291–295. Dostupné z DOI: <http://dx.doi.org/10.5551/jat.19711>.
- Veeranna V, Zalawadiya SK, Niraj A et al. Homocysteine and reclassification of cardiovascular disease risk. J Am Coll Cardiol 2011; 58(10): 1025–1033. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2011.05.028>.
- Paynter NP, Cook NR. Adding tests to risk based guidelines: evaluating improvements in prediction for an intermediate risk group. BMJ 2016; 354: i4450. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.i4450>.
- Schnyder G, Roffi M, Flammer Y et al. Effect of homocysteine-lowering therapy with folic acid, vitamin B12, and vitamin B6 on clinical outcome after percutaneous coronary intervention: the Swiss Heart study: a randomized controlled trial. JAMA 2002; 288(8): 973–979. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.288.8.973>.
- Holmes MV, Newcombe P, Hubacek JA et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet 2011; 378(9791): 584–594. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(11)60872–6>.
- Clarke R, Bennett DA, Parish S et al. Homocysteine and coronary heart disease: meta-analysis of MTHFR case-control studies, avoiding publication bias. PLoS Med 2012; 9(2): e1001177. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pmed.1001177>.
- Vincent KR, Braith RW, Bottiglieri T et al. Homocysteine and lipoprotein levels following resistance training in older adults. Prev Cardiol 2003 Fall; 6(4): 197–203. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1520–037x.2003.01723.x>.
- Pizzorno J. Homocysteine: Friend or Foe? Integr Med (Encinitas) 2014; 13(4): 8–14.
- Kumar A, Palfrey HA, Pathak R et al. The metabolism and significance of homocysteine in nutrition and health. Nutr Metab (Lond) 2017; 14 : 78. Dostupné z DOI: <http://10.1186/s12986–017–0233-z>.
- Ganguly P, Alam SF. Role of homocysteine in the development of cardiovascular disease. Nutr J 2015; 14 : 6. Dostupné z DOI: <http://dx.doi.org/10.1186/1475–2891–14–6>.
- Broxmeyer L. Heart disease: the greatestrisk‘factor of them all. Med Hypotheses 2004; 62(5): 773–779. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mehy.2003.12.018>.
- Dias V, Bamforth F, Forward L et al. Evaluation and intermethod comparison of the Bio-Rad high-performance liquid chromatographic method for plasma total homocysteine. Clin Chem 1998; 44(10): 2199–201.
- Pfeiffer CM, Huff DL, Smith SJ et al. Comparison of plasma total homocysteine measurements in 14 laboratories: an international study. Clin Chem 1999; 45(8 Pt 1): 1261–1268.
- Flicker L, Vasikaran SD, Thomas J et al. Efficacy of B vitamins in lowering homocysteine in older men: maximal effects for those with B12 deficiency and hyperhomocysteinemia. Stroke 2006; 37(2): 547–549. Dostupné z DOI: <http://dx.doi.org/10.1161/01.STR.0000198815.07315.68>.
- Nicoll R, Howard J, Henein M. A review of the effect of diet on cardiovascular calcification. Int J Mol Sci 2015; 16(4):8861–8883. Dostupné z DOI: <http://dx.doi.org/10.3390/ijms16048861>.
- Herrmann M, Schorr H, Obeid R et al. Homocysteine increases during endurance exercise. Clin Chem Lab Med 2003; 41(11): 1518–1524. Dostupné z DOI: <http://dx.doi.org/10.1515/CCLM.2003.233>.
- Deminice R, Ribeiro DF, Frajacomo FT. The effects of acute exercise and exercise training on plasma homocysteine: A meta-analysis. PloS One 2016; 11(3): e0151653. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0151653>.
- Pettigrew LC, Bang H, Chambless LE et al. [Vitamin Intervention for Stroke Prevention Investigators.]. Assessment of pre-and post-methionine load homocysteine for prediction of recurrent stroke and coronary artery disease in the Vitamin Intervention for Stroke Prevention Trial. Atherosclerosis 2008; 200(2): 345–349. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosis.2007.11.014>.
- Toole JF, Malinow MR, Chambless LE et al. Lowering homocysteine in patients with ischemic stroke to prevent recurrent stroke, myocardial infarction, and death: the Vitamin Intervention for Stroke Prevention (VISP) randomized controlled trial. JAMA 2004; 291(5): 565–575. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.291.5.565>.
- Bønaa KH, Njølstad I, Ueland PM et al. Homocysteine lowering and cardiovascular events after acute myocardial infarction. N Engl J Med 2006; 354(15): 1578–1588. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa055227>.
- Lonn E, Yusuf S, Arnold MJ et al. [Heart Outcomes Prevention Evaluation (HOPE) 2 Investigators]. Homocysteine lowering with folic acid and B vitamins in vascular disease. N Engl J Med 2006; 354(15): 1567–1577. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa060900>.
- Albert CM, Cook NR, Gaziano JM et al. Effect of folic acid and B vitamins on risk of cardiovascular events and total mortality among women at high risk for cardiovascular disease: a randomized trial. JAMA 2008; 299(17): 2027–2036. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.299.17.2027>.
- [VITATOPS Trial Study Group]. B vitamins in patients with recent transient ischaemic attack or stroke in the VITAmins TO Prevent Stroke (VITATOPS) trial: a randomised, double-blind, parallel, placebo-controlled trial. Lancet Neurol 2010; 9(9): 855–865. Dostupné z DOI: <http://dx.doi.org/10.1016/S1474–4422(10)70187–3>.
- Wang X, Qin X, Demirtas H et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet 2007; 369(9576): 1876–1882. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(07)60854-X>.
Štítky
Angiologie Diabetologie Interní lékařství Kardiologie Praktické lékařství pro dospěléČlánek vyšel v časopise
Athero Review

2020 Číslo 1
-
Všechny články tohoto čísla
- Komentár k novým odporúčaniam pre manažment dyslipidémií a kardiovaskulárne riziko z pohľadu diabetes mellitus
- Hypercholesterolémia ako rizikový faktor pre poruchu sluchu: Máme dostatok dôkazov?
- Kyselina močová a význam snižování její hladiny z hlediska prevence aterosklerózy a kardiovaskulárních onemocnění
- Editorial
- Editorial
- Inzulinová rezistence a ateroskleróza: jak zvýšit inzulinovou senzitivitu
- Úskalí dietoterapie při dyslipidemiích
- ASCOT Legacy: první dlouhodobé sledování vlivu antihypertenzivní léčby v kombinaci se statinem na mortalitu
- Profil pacientů s nekontrolovanou arteriální hypertenzí a/nebo dyslipidemií v primární péči v Česku – studie LipitenCliDec: výsledky 1. fáze
- Účinnosť a bezpečnosť nízkej dávky kolchicínu po infarkte myokardu: komentár ku štúdii Colchicine Cardiovascular Outcomes Trial (COLCOT)
- Horúce novinky zo štúdie ODYSSEY OUTCOMES (kongres American Heart Association november 2019)
- Rešerše zajímavých článků ze zahraniční literatury
- Zprávy z odborných akcí ČSAT
- Homocysteínový konsenzus
- Athero Review
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Kyselina močová a význam snižování její hladiny z hlediska prevence aterosklerózy a kardiovaskulárních onemocnění
- Komentár k novým odporúčaniam pre manažment dyslipidémií a kardiovaskulárne riziko z pohľadu diabetes mellitus
- Homocysteínový konsenzus
- Inzulinová rezistence a ateroskleróza: jak zvýšit inzulinovou senzitivitu
