Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
Atherogenic dyslipidemia – a new target in cardiovascular prevention
Despite the huge success achieved through statin therapy in reducing LDL-C (primary endpoint) together with the reduction of cardio-cerebrovascular morbidity and mortality still remains high cardiovascular risk. This reflects the rise in obesity, increased metabolic syndrome and type 2 diabetes, which is characterized by high prevalence of atherogenic dyslipidemia. Atherogenic dyslipidemia is characterized by a cluster of quantitative and qualitative changes in the metabolism of lipids and lipoproteins, leading to increased aterogenicity of plasma: increased concentration of the triglycerides and apo C-III-rich VLDL particles, the quality modified small dense LDL particles, quantitative and qualitative changes in HDL-C particles with loss of cardioprotectivity, increased concentration of remnant lipoprotein particles and the presence of postprandial hyperlipidemia. Targeting the atherogenic dyslipidemia complex is a next extension of the therapeutic targets. From the existing lipid-lowering agents, we should review the effect of fibrates in combination therapy in patients with atherogenic dyslipidemia. Near future are selective PPARα modulators, a little further ahead is therapy directly targeting the metabolism of triglyceride-rich lipoproteins. These options represent a new opportunity to reduce cardiovascular risk by influencing the complex atherogenic dyslipidemia (fig, tab. 3) [68].
Key words:
atherogenic dyslipidaemia – residual cardiovascular risk – indicators of plasma atherogenicity – statins – fibrates – selective PPARα modulators – CETP inhibitors – niacin – PCSK9 inhibitors – omega 3 fatty acids – apo C-III inhibitors
Authors:
Ľubomíra Fábryová
Authors‘ workplace:
Metabol KLINIK s. r. o., Ambulancia pre diabetológiu, poruchy látkovej premeny a výživy, Bratislava
Published in:
AtheroRev 2016; 1(3): 126-137
Category:
Reviews
Overview
Napriek obrovskému úspechu dosiahnutému vďaka statínovej liečbe pri znižovaní LDL-C (primárny cieľ) so súčasnou redukciou kardio-cerebrovaskulárnej morbidity a mortality ostáva stále vysoké KV-riziko. Je to vďaka nárastu obezity a s ňou súvisiaceho nárastu metabolického syndrómu a DM 2. typu, pre ktoré je typická prítomnosť vysokoprevalentnej aterogénnej dyslipidémie. Aterogénnu dyslipidémiu charakterizuje kluster kvantitatívnych i kvalitatívnych zmien v metabolizme lipidov a lipoproteínov, ktoré vedú ku zvýšenej aterogenicite plazmy: zvýšená koncentrácia na triacylglyceroly a apo C-III bohatých VLDL-častíc, kvalitatívne zmenené malé denzné LDL-častice, kvantitatívne a kvalitatívne zmeny HDL-C častíc so stratou kardioprotektivity, zvýšená koncentrácia remnantných lipoproteínových častíc a prítomnosť postprandiálnej hyperlipidémie. Zameranie sa na komplex aterogénnej dyslipidémie predstavuje rozšírenie terapeutických cieľov. Z existujúcich hypolipidemík by sme mali prehodnotiť efekt fibrátov v kombinačnej liečbe u pacientov s aterogénnou dyslipidémiou. Blízkou budúcnosťou sú selektívne PPARα modulátory, trochu vzdialenejšou budúcnosťou bude liečba zameraná priamo na metabolizmus lipoproteínov bohatých na triacylglyceroly. Tieto možnosti predstavujú novú príležitosť na redukciu KV-rizika ovplyvnením komplexu aterogénnej dyslipidémie (obr, tab. 3) [68].
Kľúčové slová:
aterogénna dyslipidémia – fibráty – indikátory aterogenicity plazmy – inhibítory apo C-III – inhibítory CETP – inhibítory PCSK9 – niacín – reziduálne kardiovaskulárne riziko – selektívne PPARα modulátory – statíny – omega 3 mastné kyseliny
Úvod
Napriek podstatnému zlepšeniu zdravotníckej starostlivosti v ostatných desaťročiach, predstavujú kardiovaskulárne (KV) ochorenia a ich prevencia stále obrovskú výzvu v celosvetovom meradle. Podľa Svetovej zdravotníckej organizácie (2015) ostávajú KV-ochorenia najčastejšou príčinou úmrtia Európanov (40 % mužov a 49 % žien, v absolútnych číslach – 4 milióny úmrtí ročne).
Mortalita na KV-ochorenia a cievne mozgové príhody klesá, ale morbidita na tieto ochorenia sa zvyšuje. Narastá počet hospitalizácií, KV-intervencií s nárastom potrebnej medikácie a rehabilitácie, čo všetko neuveriteľne zvyšuje sociálno-ekonomické náklady a záťaž systému zdravotnej starostlivosti naprieč Európou.
Epidemiologické, genetické, experimentálne a intervenčné klinické štúdie potvrdili kľúčovú úlohu LDL-cholesterolu (LDL-C) v rozvoji aterosklerotických kardio-cerebrovaskulárnych príhod. Súčasné štandardy prevencie kardio-cerebrovaskulárnych ochorení zdôrazňujú ako primárny cieľ ovplyvnenie LDL-C statínovou liečbou ako v primárnej, tak aj sekundárnej prevencii [1–3]. Z metaanalýzy 27 randomizovaných klinických štúdií (RCT) v CTT (Cholesterol Treatment Trialists’Collaboration) statíny viedli ku redukcii rizika veľkých koronárnych príhod o 24 % na každé zníženie LDL-C o 1 mmol/l (95 % CI 0,73–0,79), cievnej príhody o 15 % (0,80–0,89) a koronárnych revaskularizácií o 24 % (0,73–0,79). Rozsah týchto benefitov je rovnaký u mužov a žien, fajčiarov a nefajčiarov, u starých alebo mladých osôb, u osôb s rôznymi stupňami obezity, s rôznym krvným tlakom a glykémiou [4]. Intenzifikovaná terapia statínmi vedie v porovnaní s terapiou štandardnými dávkami statínov ku ďalšej redukcii kardio-cerebrovaskulárnych príhod, avšak s limitovaným potenciálom tolerability, účinnosti a s vyšším rizikom rozvoja nežiaducich udalostí [5].
Napriek poklesu alebo dosahovaniu cieľových hodnôt pre LDL-C pri terapii statínmi (v štandardných aj intenzifikovaných dávkach) sa KV-riziko nedarí úplne eliminovať a reziduálne KV-riziko ostáva stále vysoké [6].
Ďalšie zníženie LDL-C sa dá dosiahnuť kombináciou statínov s nestatínovými hypolipidemikami (selektívny inhibítor absorpcie cholesterolu – ezetimib, inhibítory PCSK9 – humánne monoklonálne protilátky proti proproteín konvertáze subtilizín/kexín typ 9) [7,8].
U pacientov s akútnym koronárnym syndrómom (AKS) pridanie ezetimibu k statínovej terapii (simvastatínu) viedlo k významnému poklesu primárneho i zloženého „endpointu“, tento pokles bol priamoúmerný k redukcii LDL-C [9].
Údaje z rozsiahleho programu klinických štúdií potvrdzujú vysokú účinnosť inhibítorov PCSK9 (evolokumab, alirokumab) v redukcii LDL-C a dovoľujú nám predpokladať ďalšie zníženie kardiovaskulárnych príhod [10,11].
Otázkou však ostáva, či „iba“ ovplyvnenie LDL-C, hoci včasné a razantné, stačí v súčasnosti na redukciu KV-rizika. Zodpovedať túto otázku je zásadné, pretože čelíme pandémii obezity, s ktorou súvisí i nárast osôb s metabolickým syndrómom (MS) a ochorením diabetes mellitus 2. typu (DM2T) [12]. Práve pre túto populáciu je charakteristická vysoko prevalentná aterogénna dyslipidémia (diabetická dyslipidémia, aterogénna triáda, aterogénny lipoproteínový fenotyp, non-LDL-dyslipidémia), ktorá je spojená napriek maximalistickej statínovej liečbe s vysokým reziduálnym rizikom rozvoja KV-komplikácií (u diabetikov 2. typu nielen makrovaskulárnych, ale aj mikrovaskulárnych komplikácií).
Aterogénna dyslipidémia predstavuje (popri LDL-C) ďalší možný terapeutický cieľ pre redukciu KV-rizika.
Charakteristika aterogénnej dyslipidémie
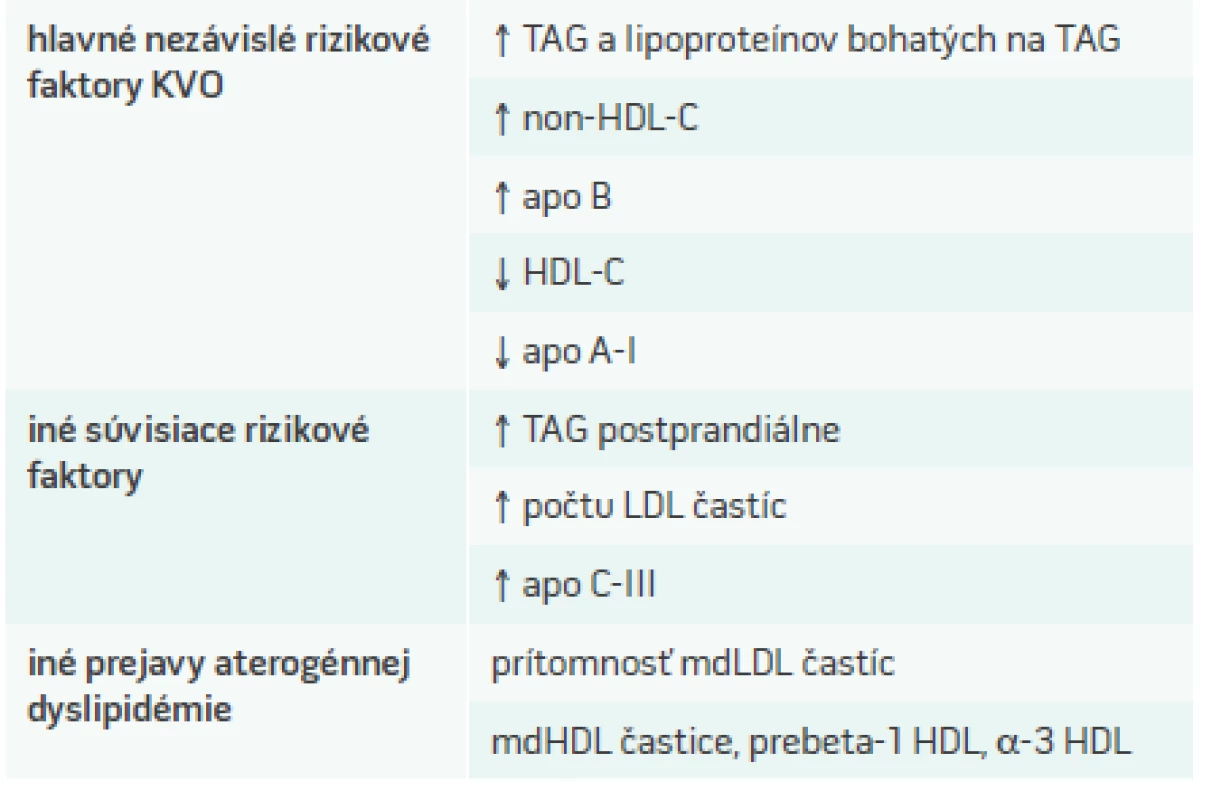
Aterogénnu dyslipidémiu charakterizuje kluster kvantitatívnych i kvalitatívnych zmien v metabolizme lipidov a lipoproteínov, ktoré vedú ku zvýšenej aterogenicite plazmy [13]:
- zvýšená koncentrácia na triacylglyceroly (TAG) a apolipoproteín C-III (apo C-III) bohatých veľkých VLDL (VLDL1) častíc – pri rutínnom laboratórnom vyšetrení zisťujeme zvýšené hodnoty TAG (schéma 1)
- kvalitatívne zmenené malé denzné LDL-častice (mdLDL) so zvýšenou koncentráciou apo B pri kvantitatívne normálnych alebo ľahko zvýšených hodnotách LDL-C
- kvantitatívne a kvalitatívne zmeny HDL-C (znížené koncentrácie cholesterolu transportovaného v HDL časticiach, vznik malých denzných HDL častíc so stratou kardioprotektivity)
- zvýšená koncentrácia remnantných lipoporoteínových častíc a
- prítomnosť postprandiálnej hyperlipidémie (tab. 1)
![Schéma 1. Centrálna úloha na triacylglyceroly bohatých častíc v komplexe aterogénnej dyslipidémie [27]](https://pl-master.mdcdn.cz/media/image/a07cb7d9f3cebbddab17364d7c3c2202.png?version=1537795628)
Prevalencia aterogénnej dyslipidémie
Aj keď prevalencia aterogénnej dyslipidémie nie je exaktne známa, údaje nám neustále pribúdajú. V štúdii The Copenhagen General Population Study malo približne 45 % mužov a 30 % žien hladinu triacylglycerolov (TAG) ≥ 1,7 mmol/l s alebo bez HDL-cholesterolu (HDL-C) < 1 mmol/l. V štúdii Turkish Adults Risk Factor Study bola podobná situácia v tureckej populácii a zvyšujúca sa prevalencia aterogénnej dyslipidémie súvisela s nárastom metabolického syndrómu (40 % mužov a 35 % žien malo TAG > 1,7 mmol/l a HDL-C < 0,9 mmol/l). Vo švédskom národnom registri je registrovaných > 75 000 diabetikov 2. typu, z nich 38 % má neliečenú hypertriacylglycerolémiu (TAG > 1,7 mmol/l a ≤ 4,0 mmol/l v kombinácii s alebo bez nízkeho HDL-C). Viac ako jedna tretina pacientov s ischemickou chorobou srdca (ICHS) v EUROASPIRE III mala zvýšené hodnoty TAG ≥ 1,7 mmol/l s alebo bez nízkeho HDL-C. V štúdii PROCAM mal 2-násobne vyšší počet pacientov po prekonanom infarkte myokardu (IM) zvýšené TAG ≥ 2,28 mmol/l alebo HDL-C < 1,05 mmol/l oproti kontrolnej skupine [13]. Ďalšie údaje o prevalcncii aterogénnej dyslipidémie máme zo štúdie EURIKA (European Study on Cardiovascular Risk Prevention and Management in Usual Daily Practice), do ktorej bolo zaradených 7 461 pacientov bez KV-ochorenia s minimálne jedným KV-rizikovým faktorom. Aterogénna dyslipidémia bola definovaná nasledovne: TAG ≥ 2,26 mmol/l alebo HDL-C < 1 mmol/l u mužov a < 1,3 mmol/l u žien. Podľa AHA/ACC kritérií v skupine pacientov bez statínovej liečby a s vysokým rizikom rozvoja KV-ochorenia (diabetici 2. typu, riziko rozvoja KV-ochorenia ≥ 7,5 %) bolo 28,9 % osôb s vysokými hodnotami TAG, 31,7 % s nízkymi hodnotami HDL-C a 16,3 % s kombináciou zvýšených TAG a nízkych koncentrácií HDL-C. V skupine pacientov s nízkym rizikom (bez DM2T, riziko rozvoja KV-ochorenia < 7,5 %) boli proporcie nasledovné: 11,6 %; 17,9 % a 4,9 %. Podobné výsledky vyšli aj pri definovaní vysokého rizika podľa európskych kritérií (DM2T alebo SCORE-HDL ≥ 5 %) oproti pacientom s nízkym rizikom (bez DM2T alebo SCORE-HDL < 5 %). Prevalencia aterogénnej dyslipidémie bola vyššia u pacientov s DM2T, ale podobná u pacientov užívajúcich alebo neužívajúcich statínovú liečbu [14].
Slovenská diabetologická spoločnosť (SDS) zorganizovala v rokoch 2003 až 2005 v rámci Národného diabetologického programu Ministerstva zdravotníctva SR projekt „Prevalencia diabetes mellitus na Slovensku“. V rámci tohto projektu sa zisťovala aj prevalencia jednotlivých zložiek metabolického syndrómu (MS). Prevalencia MS sa pohybovala v závislosti od použitých kritérií od 20,1 do 38,1 %. Z týchto údajov sa dá vydedukovať aj prevalencia aterogénnej dyslipidémie, vzhľadom na to, že prítomnosť jej charakteristických zložiek (↑TAG a ↓HDL-C) je integrálnou súčasťou MS [15]. V populácii novodiagnostikovaných diabetikov 2. typu bola takmer 90% prevalencia porúch metabolizmu lipidov a lipoproteínov, až 84,9 % novodiagnostikovaných diabetikov malo hodnoty LDL-C > 2,5 mmol/l, 59,8 % malo TAG > 1,7 mmol/l, 57,1 % sledovanej populácie malo nižšie hodnoty HDL-C (muži < 1,1, ženy < 1,3 mmol/l) [16].
Patofyziológia aterogénnej dyslipidémie
Črtou aterogénnej dyslipidémie je hypertriacylglycerolémia v dôsledku inzulínovej rezistencie, ktorá vedie k zvýšenému uvoľňovaniu voľných mastných kyselín (VMK). VMK môžu pochádzať z dvoch zdrojov: z abnormálnej lipolýzy na TAG bohatých lipopoproteínov v cirkulácii a z intracelulárnej lipolýzy tukového tkaniva. VMK sa pri zvýšenej intracelulárnej lipolýze dostávajú do cirkulácie, sú vychytávané pečeňou a v pečeni sú z VMK syntetizované TAG, ktoré sú základom pre syntézu VLDL1. Redukcia expresie hladín lipoproteínovej lipázy (LPL) v tukovom tkanive, ako aj redukcia aktivity LPL v kostrovom svalstve, vedie ku kompetícii lipolýzy medzi VLDL-časticami (hepatálneho pôvodu) a chylomikrónmi (intestinálneho pôvodu), dôsledkom čoho vzniká postprandiálna lipémia.
Zvýšená aktivita cholesterylester transferového proteínu (CETP), ktorý má za úlohu sprostredkovať výmenu TAG z VLDL-častíc do LDL-častíc a esterov cholesterolu (CE) z LDL-častíc do VLDL-častíc, za vzniku na cholesterol bohatých aterogénnych remnantných VLDL-častíc a LDL-častíc bohatých na TAG. TAG sú následne z LDL-častíc masívne odhydrolyzovávané LPL alebo hepatálnou lipázou (HL) za vzniku mdLDL-častíc.
Podobným mechanizmom vznikajú aj mdHDL-častice. Pri zvýšenej aktivite CETP dochádza ku výmene TAG a CE medzi VLDL a HDL-časticami za vzniku na TAG bohatých HDL-častíc, TAG z týchto častíc sú odhydrolyzovávané HL za vzniku mdHDL-častíc, ktoré strácajú svoju kardioprotektivitu. Na TAG bohaté HDL-častice podliehajú ďalšej modifikácii, ktorá vedie ku oddeleniu štrukturálne zaujímavého apoliproteínu (apo) AI (je podstatne rýchlejšie odbúravaný ako v spojení s HDL-časticou). Jedným z miest vylučovania apo AI sú obličky, výsledkom je redukcia apo AI, ako aj ako aj redukcia počtu HDL-častíc.
V súvislosti s metabolizmom VLDL-častíc sa veľa hovorí o apo C-III, ktorého prítomnosť na povrchu VLDL a LDL-častíc výrazne ovplyvňuje ich metabolizmus a umožňuje rozdelenie lipoproteínových častíc obsahujúcich apo B na metabolicky rozdielne typy vo vzťahu ku ateroskleróze. Apo C-III je inhibítorom aktivity LPL, interferuje pri interakcii VLDL a LDL-častíc s pečeňovými receptormi, čím spomaľuje vychytávanie týchto lipoproteínových častíc z plazmy (schéma 2) [17].
![Schéma 2. Mechanizmus vzniku aterogénnej dyslipidémie [17]](https://pl-master.mdcdn.cz/media/image/e2fde672193b5e7b55fd3d487a615193.png?version=1537797327)
Vzťah aterogénnej dyslipidémie ku kardiovaskulárnemu riziku
Už samotný názov aterogénna dyslipidémia odzrkadľuje kauzálny vzťah medzi fenotypom a aterosklerózou (tab. 2). Veľké epidemiologické a observačné štúdie, ako aj metaanalýzy (od konca 80. rokov minulého storočia až po súčasnosť) dokázali, že zvýšené hladiny TAG (nalačno i postprandiálne), ako aj znížené hodnoty HDL-C sú spojené so zvýšeným KV-rizikom (tab. 3, obr) [13,18–24].
![Vzťah aterogénnej (non-LDL) dyslipidémie ku aterotrombóze. Upravené podľa [13]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image/197c932b9730c9527949be95a3a9a296.png)
![Dôkazy pre vzťah zvýšenej hladiny LDL-C, zvýšenej hladiny na TAG bohatých častíc a ich remnánt alebo nízkych hladín HDL-C v rozvoju KV-ochorení. Upravené podľa [13]](https://www.atheroreview.eu/media/cache/resolve/media_object_image_small/media/image/86552cd922e2302c60b10f7e0c86b738.png)

V roku 2009 bola vykonaná analýza 68 štúdií s 303 430 osobami bez predchádzajúceho KV-ochorenia – The Emerging Risk Factors Collaboration (ERFC), v ktorej každé zvýšenie koncentrácie HDL-C o 0,38 mmol/l viedlo k 22% redukcii KV-rizika. Riziko súvisiace so zvýšením TAG bolo úzko spojené s kombináciou vyšších hodnôt non-HDL-C a nízkymi hodnotami HDL-C [20].
Metaanalýza 26 statínových štúdií (24 332 KV-príhod) priniesla dôkazy, že nezávisle od dosiahnutých hladín LDL-C alebo od intenzity statínovej liečby, KV-riziko bolo nižšie pri vyšších hodnotách HDL-C, bez oslabenia tohto vzťahu pri nízkych hodnotách LDL-C. Najnižšie riziko bolo zaznamenané u osôb s nízkymi hodnotami LDL-C a vysokými hodnotami HDL-C [20].
V štúdii PROVE IT – TIMI 22 boli TAG < 1,7 mmol/l spojené s nižším rizikom rekurentných koronárnych príhod u pacientov s akútnym koronárnym syndrómom (AKS) dosahujúcich LDL-C < 1,8 mmol/l [19]. Poolovaná analýza štúdií TNT a IDEAL ukázala štatisticky významný trend zníženia KV-príhod súčasne so znižovaním hladín TAG [20]. Zaujímavé údaje máme zo štúdie (PROCAM populácia) porovnávajúcej vzťah non-LDL dyslipidémie ku riziku infarktu myokardu (IM) u mužov po prekonanom IM vs u mužov bez prekonaného IM. Muži s hodnotami HDL-C < 1,15 vs HDL-C > 1,15 mali 2,6krát vyššie riziko IM a muži s TAG >1,71 mmol/l mali riziko IM 1,4krát vyššie. Efekt bol synergistický, v prípade TAG > 1,71 mmol/l a súčasne HDL-C <1,15 mmol/l sa riziko IM sa zvýšilo na 5-násobok, napriek dosahovaniu cieľových hodnôt pre LDL-C (< 2,58 mmol/l) [23].
Ďalšia z epidemiologických štúdií bola dizajnovaná na vzťah TAG a HDL-C ku reziduálnemu riziku pri redukcii LDL-C na odporúčané cieľové hodnoty. Odds ratio pre ICHS sa zvýšilo približne o 20 % na každé zvýšenie TAG o 0,25 mmol/l, odds ratio pre ICHS sa znížilo približne o 40 % na každé zvýšenie HDL-C o 0,20 mmol/l. Vysoké TAG (> 2,15 mmol/l) a nízky HDL-C (< 0,78 mmol/l) synergisticky zvyšujú odds ratio na 10 pri hodnotách LDL-C 1,89 vs 2,34 mmol/l [24].
V ostatných rokoch boli publikované ďalšie práce, ktoré podčiarkli význam lipoproteínov bohatých na TAG a ich remnantných častíc vo vzťahu k reziduálnemu makrovaskulárnemu riziku. Varbo et al publikovali zaujímavú genetickú štúdiu, ktorá potvrdila význam hladiny TAG vo vzťahu k ICHS. V ďalšom výskume sa potvrdila nezávislosť tohto vzťahu od HDL-C. Najnovšie diskutované údaje sa týkajú asociácie remnantných lipoproteínových častíc s chronickým subklinickým zápalom [25–30].
Indikátory aterogenicity plazmy
V súčasnosti existujú viaceré alternatívne možnosti zhodnotenia prítomnosti aterogénnej dyslipidémie v klinickej praxi.
Plazmatická koncentrácia TAG nalačno je veľmi dobrým prediktorom (pri gradientnej gélovej elektroforéze) veľkosti LDL-častíc, pričom výskyt mdLDL-častíc je vyšší pri zvýšených hladinách TAG.
Margaret Austinová vo svojich prácach už v roku 1988 potvrdila zvýšený výskyt mdLDL (fenotypu B) pri hladinách TAG približne 1,5–1,7 mmol/l [31]. Griffin publikoval, že zvýšenie hladiny mdLDL-častíc nastáva už pri zvýšení TAG > 1,3 mmol/l. Miller dokonca poukázal na ich vzostup pri hodnotách TAG okolo 1,1 mmol/l [32]. Podľa prác ďalších autorov sa KV-riziko zvyšuje už pri hodnotách TAG okolo 1,0 mmol/l [33].
Z ďalších alternatív je možné použiť index pomeru T-C/HDL-C alebo výpočet non-HDL-C. Non-HDL-C vyjadruje koncentráciu všetkých aterogénnych lipoproteínov, bez potreby stanovenia TAG. Zlepšuje predikciu KV-rizika u pacientov s hyperTAG, diabetikov 2. typu, u pacientov s metabolickým syndrómom a chronickým obličkovým ochorením. Podľa súčasných platných odporúčaní je sekundárnym terapeutickým cieľom. Dá sa vypočítať jednoducho:
non-HDL-C = celkový cholesterol – HDL-C
cieľové hodnoty sú o 0,8 mmol/l vyššie ako cieľové hodnoty pre LDL-C [1,2,34].
Meranie apolipoproteínu (apo) B považujú niektoré odporúčania za najlepšie, vzhľadom na presné stanovenie počtu LDL-častíc. Apo B je apolipoproteín nachádzajúci sa v aterogénnych lipoproteínoch. Vo VLDL, IDL, LDL, Lp(a) sa nachádza apo B-100, v chylomikrónoch a chylomikrónových remnantných častiacich sa nachádza apo B-48. Nosičmi ~90 % všetkého apo B v plazme sú obvykle LDL-častice. Vyššie koncentrácie apo B pri rovnakých koncentráciách LDL v plazme hovoria o prítomnosti fenotypu B – mdLDL-častíc (schéma 2). Veľkosť častíc plazmatických lipoproteínov patrí k významným indikátorom aterogenicity plazmy, a teda k indikátorom KV-rizika novej generácie. Podľa európskych odporúčaní je však rovnako akceptovateľné meranie apo B, ako aj výpočet non-HDL-C (tzv. parameter zadarmo) [1,34].
Aterogénny index plazmy (AIP) je logaritmicky transformovaný molárny pomer TAG a HDL-C [(AIP = log(TAG/HDL-C)]. AIP významne koreluje s veľkosťou lipoproteínových častíc (HDL, LDL a VLDL). Jedným číslom vyjadruje a definuje aterogénny fenotyp plazmy presnejšie ako klasické biochemické indikátory, ako sú napríklad celkový cholesterol, LDL-C, HDL-C, TAG, apo B, apo A I alebo index pomeru T-C/HDL-C, resp. LDL-C/HDL-C. Je to logické vyústenie faktu, že regulácia veľkosti lipoproteínových subpopulácií je spojená predovšetkým s hladinou TAG. Na základe údajov AIP získaných z populácií s rôznym stupňom kardiovaskulárneho rizika (z pupočníkovej plazmy, u detí, mužov, žien, rodín probandov s predčasným infarktom myokardu a kontrolných rodín, pacientov s manifestným KV-ochorením, diabetikov 2. typu, pacientov s kombinovanou hyperlipoproteinémiou) bolo navrhnuté rozdelenie AIP do 3 rizikových kategórií: najnižšie riziko – hodnoty AIP od -0,3 do 0,1, stredné riziko od 0,1 do 0,24 a vysoké riziko nad 0,24. Hodnota AIP 0,07 zodpovedá rozhraniu medzi aterogénnym a neaterogénnym profilom podľa veľkosti LDL-častíc (AIP 0,07 = LDL 25,5 nm). AIP by mohol byť dôležitým a ľahko dostupným nástrojom ako pre stanovovanie KV-rizika, tak aj nástrojom na sledovanie účinnosti farmakologickej intervencie [35].
K dispozícii máme aj nové metódy na stanovenie lipoproteínových frakcií a subfrakcií (kontinuálna gradientná ultracentrifugácia, gradientná gélová elektroforéza, nukleárna magnetická rezonancia). Avšak tieto metódy sú drahé, technicky a časovo náročné, čo zabraňuje ich širšiemu používaniu v rutínnej klinickej praxi. Prekážkou je aj nedostatočná prediktívna hodnota výsledkov. Jednou z metód, ktorá má potenciál zlepšiť diagnostiku a následne aj manažment aterogénnej dyslipidémie, je lineárna polyakrylamidová gélová elektroforéza (PAGE) – Lipoprint. Pomocou Lipoprintu LDL stanovujeme 12 subpopulácií lipoproteínov (VLDL, IDL [1–3], LDL [1–7], HDL), identifikujeme a kvantifikujeme aterogénne lipoproteíny (VLDL, IDLc, IDLb, LDL3–7 (mdLDL), neaterogénne lipoproteíny (IDLa, HDL), lipoproteíny neurčitej aterogenicity (LDL1–2), fenotyp A a aterogénny fenotyp B. Pomocou Lipoprintu HDL stanovujeme 10 lipoproteínových subpopulácií HDL (veľké HDL – HDL1–3), intermediárne HDL (HDL4–7) a ne-antiaterogénnu HDL subpopuláciu (HDL8–10) [36].
Terapeutické možnosti
Ovplyvnenie životného štýlu
Snaha o zmenu životného štýlu je základom liečby akejkoľvek poruchy metabolizmu lipidov a lipoproteínov, o to viac to platí pre aterogénnu dyslipidémiu. Súčasťou zmeny životného štýlu je dodržiavanie diétnych opatrení, pohybovej aktivity a dosiahnutie alebo udržanie „zdravej“ telesnej hmotnosti. Takéto opatrenia sa ťažko implementujú, adherencia býva väčšinou nízka, ale treba povedať, že sú vysoko efektívne v ovplyvnení mnohých zložiek aterogénnej dyslipidémie. Vyššie uvedené opatrenia vedú k zlepšeniu inzulínovej senzitivity a všeobecne metabolického statusu, čo vedie k zlepšeniu lipidového profilu. Redukcia hmotnosti taktiež ovplyvňuje viaceré zložky aterogénnej dyslipidémie. Vedie k oddialeniu vzniku DM2T (často prítomná aterogénna dyslipidémia). V súčasnosti pribúdajú údaje o vplyve bariatrickej chirurgie na redukciu produkcie lipoproteínov bohatých na TAG. Napriek všetkým týmto pozitívam nefarmakologická liečba nepreukázala vplyv na redukciu KV-endpointov [37].
Hypolipidemiká s vplyvom na aterogénnu dyslipidémiu, ich efekt na kardiovaskulárnu moribiditu a mortalitu
Fibráty
Fibráty sú agonisty PPARα (peroxisome proliferator-activated receptors). PPARα prostredníctvom fibrátov regulujú gény jednotlivých faktorov zapojených do metabolizmu lipidov a lipoproteínov. Stimuláciou génov zapojených do metabolizmu LPL zvyšujú jej produkciu, čo vedie k zvýšenej lipolýze na TAG bohatých lipoproteínov, ako aj k zvýšenej oxidácii mastných kyselín. Inhibícia apo C-III vedie taktiež k zníženej koncentrácii lipoproteínov bohatých na TAG. Intervencia fibrátmi vedie k zmenám štruktúry aj veľkosti VLDL-častíc. Znížením obsahu apo C-III sa znižuje aj obsah TAG vo VLDL-časticiach čo vedie k produkcii menších VLDL-častíc, ktoré menej interagujú s CETP. Tým sú generované väčšie LDL-častice, ktoré sú rozpoznávané klasickým LDL-receptorom. Expresia apo A-V sprostredkovaná aktiváciou PPARα fibrátmi má tiež dramatický vplyv na pokles hladiny TAG. Aktivácia PPARα reguluje expresiu génov metabolizmu HDL-častíc (expresia génov apo A-I, apo A-II, expresia génu pre LPL, expresia SR-BI receptora a ABCA-I transportéra). Stimulácia expresie génov apo A-I a apo A-II vedie k zvýšeniu syntézy apo A-I a apo A-II, čo korešponduje so zvýšenou formáciou HDL-častíc. Stimulácia expresie génov pre ABCA-I transportér (sprostredkuje eflux cholesterolu cez CERP – cholesterol efflux regulatory protein) a SR-BI receptor (sprostredkuje vychytávanie a katabolizmus HDL-častíc) vedie k zvýšeniu reverzného transportu cholesterolu. V súčasnosti sa potvrdzujú aj tzv. pleiotropné účinky fibrátov (ovplyvnenie inzulínovej senzitivity, vplyv na progresiu inzulínovej rezistencie, ovplyvnenie endotelovej dysfunkcie, antitrombotické, protizápalové a antioxidačné účinky).
Významným účinkom fibrátov je redukcia TAG o 25–50 % a zvýšenie HDL-C o 15–25 %. Taktiež klesá cholesterol vo frakcii VLDL, kým pokles cholesterolu v LDL-časticiach je menší (5–20 %) v závislosti od použitého fibrátu (fenofibrát spĺňa všetky uvedené atribúty). Z kvalitatívnych zmien je významný najmä pokles frakcie mdLDL-častíc a skrátenie trvania postprandiálnej lipémie. Napriek vyššie uvedenému vplyvu fibrátov na zložky aterogénnej dyslipidémie sú výsledky klinických štúdií s rôznymi fibrátmi z pohľadu KV-prevencie menej impresívne.
Nedávno publikovaný systematický prehľad 13 fibrátových randomizovaných klinických štúdií svedčí o signifikantnom 12% efekte fibrátov v porovnaní s placebom na KV-ochorenia, ale nie o redukcii celkovej mortality alebo redukcii úmrtí na vaskulárne ochorenia [38,39]. Avšak metaanalýza fibrátových štúdií v skupine pacientov s aterogénnou dyslipidémiou poukázala na 35% pokles KV-príhod [40].
Liečba fenofibrátom dokáže viesť ku redukcii reziduálneho mikrovaskulárneho rizika u diabetikov 2. typu (diabetickej retinopatie, nefropatie) [41]. Niektoré práce poukazujú na fakt, že v kombinácii so statínmi fibráty môžu eliminovať riziko zvýšenia glykémie spojeného so statínovou liečbou [42].
Potrebujeme však ďalšie klinické štúdie s precíznejšou selekciou pacientov s aterogénnou dyslipidémiou, ktoré by dokázali efekt buď samotných fibrátov alebo fibrátov v kombinácii so statínmi na KV-morbiditné a mortalitné endpointy.
Selektívne PPARα modulátory
Potentnejšie selektívne PPARα modulátory (SPPARM) [43] by mohli výraznejšie zredukovať TAG, ako aj mať lepší inzulín-senzitizujúci efekt, otázkou ostáva ich bezpečnosť. V pláne je veľká medzinárodná multicentrická štúdia PROMINENT (The Pemafibrate to Reduce cardiovascular OutcoMes by reducing triglycerides IN diabetic patiENTs). Bude hodnotiť pemafibrát (SPPARM) v prevencii veľkých KV-príhod u vysokorizikových diabetikov (10 000 pacientov) s TAG ≥ 2,26 mmol/l a HDL-C ≤ 1,03 mmol/l na statínovej liečbe a snáď dá odpoveď na doposiaľ nezodpovedané otázky.
Niacín (kyselina nikotínová)
Kyselina nikotínová, resp. jej deriváty sa využívali v liečbe dyslipidémií niekoľko desaťročí. Včasné klinické štúdie zo 70. rokov minulého storočia ukázali, že niacín vedie k redukcii KV-ochorení. Vysoké dávky niacínu viedli k zýšeniu HDL-C, k redukcii LDL-C, Lp(a), lipoproteínov bohatých na TAG a mdLDL-častíc. Niacín bol spojený s flushom a u diabetikov 2. typu zhoršoval inzulínovú rezistenciu a glykemickú kontrolu. Niacín s pomalým uvoľňovaním v kombinácii s laropiprantom viedol k poklesu výskytu tolerovateľných flushov asi o jednu tretinu, viedol k zlepšeniu lipidového profilu bez zvyšovania glykémie. Antiaterogénny efekt niacínu bol pripočítavaný jeho vplyvu na zvýšenie HDL-C, napriek tomu, že ovplyvňoval aj ostatné lipidy a lipoproteíny.
V štúdii ARBITER 6-HALTS (Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol 6-HDL and LDL Treatment Strategies in Atherosclerosis) viedol niacín s pomalým uvoľňovaním k regresii intimo-mediálneho zhrubnutia na karotídach u pacientov liečených statínmi. Napriek tomu štúdia zlyhala v demonštrácii benefitu na KV-ochorenia po pridaní niacínu k statínovej liečbe [44]. Štúdia AIM-HIGH (Atherothrombosis Intervention in Metabolic Syndrome with low HDL/High Triglycerides: Impact on Global Health Outcomes) taktiež napriek zlepšeniu celého lipidového spektra (HDL-C, TAG, LDL-C) nedokázala klinický benefit z pridania niacínu k liečbe statínmi [45]. V štúdii HPS2-THRIVE (Heart Protection Study 2 – Treatment of HDL to reduce the Incidence of Vascular Events) niacín neviedol k redukcii počtu KV-príhod, ale zvýšil riziko nežiaducich udalostí u pacientov s vaskulárnym ochorením a dobre kontrolovaným LDL-C počas obdobia ďalšieho sledovania [46] . V súvislosti s týmito štúdiami sa diskutovalo o tom, že efekt niacínu na redukciu apo B lipoproteínov je kvantitatívne nižší, zvýšenie koncentrácie HDL-C nebolo sprevádzané zlepšením funkcie HDL-častíc a v menšej miere došlo k redukcii lipoproteínov bohatých na TAG, z čoho vyplynulo, že je menej efektívny v liečbe zložiek aterogénnej dyslipidémie.
Inhibítory cholesteryl ester transfer proteínu
CETP (cholesteryl ester transfer proteín) sprostredkuje výmenu neutrálnych lipidov (estery cholesterol) medzi denznejšími lipoproteínmi (HDL a LDL) a lipoproteínmi bohatými na TAG. Napr. transfer TAG z lipoproteínov bohatých na TAG do HDL a LDL výmenou za estery cholesterolu z HDL a LDL do lipoproteínov bohatých na TAG. CETP sprostredkovaná výmena neutrálných lipidov medzi HDL a lipoproteínmi bohatými na TAG je jednou z dvoch hlavných ciest, ktorými je cholesterol transportovaný z tkanív do pečene, odkiaľ je následne vylúčený do žlče a stolice (reverzný transport cholesterolu).
Inšpiráciou pre vývoj CETP inhibítorov boli vysoké hodnoty HDL-C u pacientov s geneticky podmieneným deficitom CETP. Dnes však už vieme, že inhibícia CETP síce zvyšuje koncentrácie HDL-C, ale tento efekt môže byť eliminovaný poškodeným reverzným transportom cholesterolu v dôsledku dysfunkcie HDL-častíc. Torcetrapib viedol v rôznych štúdiách dokonca viac ako 100% zvýšeniu HDL-C. Avšak štúdia ILLUMINATE (the Investigation of Lipid Level Management to Understand Its Impact in Atherosclerotic Events) porovnávajúca torcetrapib 60 mg v kombinácii s atorvastatínom voči samostnému atorvastatínu bola predčasne ukončená. Dôvodom bol štatisticky významne vyšší výskyt veľkých KV-príhod napriek vzostupu HDL-C o 72 % a poklesu LDL-C o 25 %. Torcetrapib zlyhal v ovplyvnení progresie aterosklerózy a viedol u niektorých osôb aj ku zvýšeniu krvného tlaku [47].
Začiatkom mája 2012 bol pozastavený vývoj dalcetrapibu po získaní interim analýzy z klinického skúšania dal-OUTCOMES, ktorá poukázala na to, že dalcetrapib nevedie ku redukcii rekurentných KV-príhod u pacientov s akútnym koronárnym syndrómom (napriek zvýšeniu HDL-C, miernej redukcii TAG, bez efektu na apo B) [48].
Nedávno bola zastavená aj štúdia ACCELERATE (Assessment of Clinical Effects of Cholesteryl Ester Transfer Protein Inhibition With Evacetrapib in Patients at a High-Risk for Vascular Outcomes) s evacetrapibom, ktorý napriek tomu, že viedol k redukcii LDL-C o 37 % a zvýšeniu HDL-C o 130 %, zlyhal v redukcii veľkých KV-príhod (IM, cievna mozgová príhoda – CMP, angina pectoris alebo KV-úmrtie) [49].
Sumarizácia výsledkov z doposiaľ publikovaných klinických štúdií nepodporuje efektivitu CETP inhibície v KV-prevencii. Dôvodov je zrejme viacej. Samotná inhibícia CETP nepôsobí antiaterogénne – nestačí iba zvýšenie koncentrácie HDL-C, pozornosť potrebujeme sústrediť na ovplyvnenie funkčnosti HDL-častíc. K negatívnemu výsledku štúdií mohol prispieť aj fakt, že do nich boli zaradení pacienti s relatívne normálnymi hodnotami HDL-C. Tak isto sa zdá, že zameranie sa iba na jednu časť komplexu aterogénnej dyslipidémie (HDL-C) bez ovplyvnenia ďalších abnormalít (lipoproteínov bohatých na TAG, lipoproteínov obsahujúcich apo B) nie je efektívnou stratégiou.
Selektívnejší a potentnejší CETP ihibítor – anacetrapib s efektom na zvýšenie HDL-C, na redukciu LDL-C a apo B-100, na zvýšenie pomeru TAG/cholesterol v LDL-časticiach, zvýšenie veľkosti LDL-častíc a s efektom na vychytávanie LDL-apo B-100, bez nežiaduceho efektu na krvný tlak) by mohol viesť k redukcii KV-príhod. Odpovede na nezopodvedané otázky by mohla priniesť štúdia DEFINE (Determining of the EFficacy and Tolerability of CETP INhibition with anacetrapib) [50].
Omega 3 mastné kyseliny
Omega 3 mastné kyseliny (MK) majú kardiovaskulárne benefity a bývajú odporúčané v terapii hyper-TAG. Známy je antiarytmický efekt omega 3 MK, efekt na redukciu plazmatických TAG, na zníženie krvného tlaku, zníženie agregácie trombocytov, zlepšenie vaskulárnej reaktivity, aj protizápalové účinky. Exaktný mechanizmus pôsobenia omega 3 MK stále nie je objasnený, predpokladáme, že ich hypolipidemický efekt je spôsobený redukciou hepatálnej lipogenézy, zvýšenou oxidáciou MK a potlačením sekrécie VLDL. Efekt omega 3 MK u pacientov skúmajú štúdie STRENGHT (Outcomes Study to Assess STatin Residual Risk Reduction With EpaNova in HiGh CV Risk PatienTs With Hypertriglyceridemia a REDUCE-IT (A Study of AMR101 to Evaluate Its Ability to Reduce Cardiovascular Events in High Risk Patients With Hypertriglyceridemia and on Statin) (clinical trial reg. nos. NCT01492361a NCT02104817, clinicaltrials.gov).
PCSK9-inhibítory
PCSK9 (proproteín konvertáza subtilizín/kexin 9) inhibítory sú známe predovšetkým razantným ovplyvnením LDL-C. Analýzy klinických štúdií ODYSSEY LONG TERM (alirokumab, n = 2 341) a OSLER (evolokumab, n = 4 465) potvrdzujú pokles KV-endopointov o 50–55 % [51,52]. Podľa metaanalýzy 24 klinických štúdií s inhibítormi PCSK9 zahrňujúca viac ako 10 000 pacientov je pokles celkovej mortality o 55 % (p = 0,015), s podobným znížením KV-mortality a IM. Po ukončení klinických štúdií FOURIER (evolokumab), ODYSSEY OUTCOMES (alirokumab) a SPIRE (bokocizumab) budeme mať k dispozícii údaje od viac ako 70 000 vysokorizikových pacientov [53–56].
Avšak v súčasnosti existujú údaje z rôznych línií výskumu, že PCSK9 ovplyvňuje aj metabolizmus ostatných lipoproteínov, najmä lipoproteínov bohatých na TAG a ich remnantných častíc. Vzťah medzi PCSK9 a lipoproteínmi bohatými na TAG sa dá predpokladať na základe napr. korelácie medzi plazmatickými hladinami PCSK9 a markermi uhľohydrátového metabolizmu, ktoré sú úzko asociované s metabolizmom TAG. Z ďalších príkladov môžeme uviesť: efekt fibrátov znižujúcich TAG na plazmatickú hladinu PCSK9, efekt PCSK9 na postprandiálnu lipémiu, na biológiu tukového tkaniva, na produkciu apoB pečeňou a črevom, efekt PCSK9 nielen na LDL receptory, ale aj na receptory ovplyvňujúce metabolizmu na TAG bohatých lipoproteínov a v neposlednom rade efekt inhibítorov PCSK9 na sérové hladiny TAG. Tieto mechanizmy nie sú ešte úplne objasnené, ale v každom prípade vzbudzujú nemalý záujem [57].
Evolokumab mal priaznivý vplyv aj na ostatné lipidové parametre: 49% redukcia apo B, 22% redukcia Lp(a), redukcia TAG a non-HDL-C. Podľa včasných výsledkov štúdie zo štúdie OSLER (Open-Label Study of Long-Term Evaluation against LDL Cholesterol) inhibícia PCSK9 vedie k signifikantnej redukcii lipoproteínov bohatých na TAG, zatiaľ čo HDL/apo AI sa zvyšuje [52]. Podobné výsledky sú viditeľné aj z klinických štúdií s alirokumabom (ODYSSEY program) [57].
Určite budeme so špeciálnym záujmom sledovať ďalšie informácie o vplyve inhibície PCSK9 na lipoproteíny bohaté na TAG, aj vzhľadom na to, že tento vplyv môže zvýšiť klinický prínos získaný zo samotného zníženia LDL-C.
Budúcnosť ovplyvňovania aterogénnej dyslipidémie
Inhibícia apo C-III
Apo C-III je inhibítorom lipoproteínovej lipázy, inhibuje aktivitu hepatálnej lipázy, zvyšuje sekréciu VLDL a znižuje vychytávanie remnantných lipoproteínov bohatých na TAG. Nosiči raritnej LOF (loss of function) mutácie v géne pre apo C-III (vedie k zníženej aktivite apo C-III) majú nízke koncentrácie TAG a nízke KV-riziko [59]. Anti-sense inhibícia apo C-III v predklinických modeloch a vo fáze I klinického skúšania u zdravých dobrovoľníkov znížila plazmatické koncentrácie apo C-III a TAG. Anti-sense inhibícia apo C-III (podávaná injekčne raz do týždňa, v monoterapii alebo v kombinácii s fibrátmi) viedla u pacientov s hyperTAG nalačno k redukcii koncetrácií TAG o 70 % (v závislosti od dávky) [60].
Inhibícia ANGPTL3 a ANGPTL4
ANGPTL (angiopoietin-like) patria do rodiny proteínov regulujúch LPL. Raritné LOF mutácie v ANGPLT3 sú spojené s nízkymi koncentráciami všetkých lipidov a lipoproteínov, vrátane TAG, LDL-C a HDL-C. Blokáda ANGPLT3 protilátkami u myší a opíc vedie k redukcii plazmatických lipidov, je spojená s redukciou produkcie VLDL a zvýšeným vychytávaním apo B lipoproteínov pečeňou. ANGPTL4 inhibuje LPL a je hlavným regulátorom aktivity LPL počas lačnenia a cvičenia. LOF mutácie sú spojené s nízkymi hladinami TAG a nízkym rizikom ischemickej choroby srdca. Inhibícia ANGPTL4 protilátkami vedie k redukcii TAG u myší a opíc. Hypolipidemický efekt farmakologickej inhibície ANGPTL3 a ANGPTL4 u ľudí čaká na potvrdenie v ďalších štúdiách [61,62].
Inhibítory mikrozomálneho triacylglyceroly transferujúceho proteínu a anti-sense apo B oligonukleotidy
Napriek tomu, že obidve liečby (inhibítor MTP – lomitapid a ani-sense oligonukleotid – ASO apo B – mipomersen) zasahujú do metabolizmu lipoproteínov bohatých na TAG, ich hlavný efekt je predovšetkým na redukciu LDL-C (schválené na liečbu pacientov s homozygotnou familiárnou hypercholesterolémiou). Liečba je finančne náročná s nežiaducimi udalosťami (hepatotoxicita). Mipomersen sa podáva injekčne, lomitapid perorálne. Nie sú ideálne na liečbu aterogénnej dyslipidémie, hoci sa často používajú v liečbe závažných geneticky podmienených hyper-TAG neodpovedajúcich na inú liečbu [63,64].
Inhibícia acetyltransferázy
Farmakologická inhibícia enzýmov biosyntézy TAG – diacylglycerol acyltransferáza (DGAT) a monoacylglycerol acyltransferáza (MGAT) sa zdá byť veľmi sľubná v liečbe obezity, diabetes mellitus a dyslipidémie, avšak zatiaľ iba u zvierat. MGAT a DGAT katalyzuje konečné kroky biosyntézy TAG. MGAT sa nachádza predovšetkým v tráviacom trakte, zatiaľ čo DGAT vo viacerých tkanivách, vrátane čreva a pečene. Pre MGAT a DGAT boli identifikované izoenzýmy s rôznou funkciou a expresiou. MGAT2 sa nachádza najmä v čreve a koordinuje 75 % syntézy TAG, zohráva dôležitú úlohu v absorpcii lipidov pochádzajúcich zo stravy. DGAT1 sa nachádza v tenkom čreve, inhibuje postprandiálne exkurzie TAG, avšak inhibícia je spojená s gastrointestinálnymi nežiadúcimi udalosťami. Vo vývoji sú aj ďalšie inhibítory DGAT1, dúfajme, že účinnejšie a bezpečnejšie [65].
Inhibítory acetyl-CoA karboxyláz
Acetyl-CoA karboxylázy (ACCs) katalyzujú biosyntézu mastných kyselín (karboxylácia acetyl-CoA na malonyl Co-A). ACC1 izoenzým sa nachádzav lipogénnych tkanivách (pečeň a tukové tkanivo), katalyzuje biosyntézu dlhoreťazcových mastných kyselín. ACC2 sa nacháza iv oxidačných tkanivách (pečeň). Izoenzým selektívne ACC inhibítory inhibujú lipogenézu a zvyšujú oxidáciu mastných kyselín, čo môže byť veľmi užitočné v liečbe diabetikov 2. typu, hyperTAG a nealkoholovej steatohepatitíde. Zatiaľ ešte neboli skúšané v klinických štúdiách [66].
ETC-1002
ETC-1002 je duálny modulátor 2 hepatálnych enzýmov, inhibuje ATP citrát lyázu a aktivuje AMPK (AMP aktivovanú proteín kinázu) v pečeni, ktorá inhibuje syntézu sterolov a mastných kyselín a urýchľuje oxidáciu mastných kyselín. U pacientov so zvýšeným LDL-C ETC-1002 vedie k redukcii LDL-C nezávisle od hladín TAG. Ďalej vedie k poklesu apo B-100, non-HDL-C, počtu LDL-častíc, znižuje zápalové markery, krvný tlak a telesnú hmotnosť. U hypercholesterolemických pacientov s intoleranciou statínov ETC-1002 znižuje non-HDL-C, celkový cholesterol, apo bez ovplyvnenia TAG a HDL-C. Sú potrebné dlhodobé štúdie na potvrdenie bezpečnosti, tolerability a účinnosti v kombinačnej liečbe v porovnaní s ostatnými hypolipidemikami [67].
Inkretíny v regulácii postprandiálnej lipémie
Vedomosti týkajúce sa ovplyvnenia postprandiálnej lipémie nám poskytli nové antidiabetiká. Inkretíny (agonisty glukagón-like peptid 1 receptora a inhibítory dipeptidyl peptidázy 4) vedú k supresii črevnej produkcie lipoproteínov, znižujú postprandiálne exkurzie TAG [68].
Z ďalších nových možností modifikácie lipidov a lipoproteínov je FGF21 (fibroblast growth factor 21) pôvodne vyvíjaný ako antidiabetikum. U obéznych diabetikov 2. typu vedie k poklesu TAG, celkového cholesterolu, LDL-C a k zvýšeniu HDL-C. FGF21 moduluje metabolizmus lipidov vo viacerých orgánoch, efekt na metabolizmus lipoproteínov bohatých na TAG však zatiaľ nebol skúmaný. Ďalšou nádejnou oblasťou je aktivácia hnedého tukového tkaniva, ktorá vedie k zvýšeniu vychytávania MK hnedým tukovým tkanivom a k vychytávaniu remnantných častíc pečeňou, čoho dôsledkom je zníženie TAG a celkového cholesterolu.
Záver
Napriek obrovskému úspechu dosiahnutému vďaka statínovej liečbe pri znižovaní LDL-C so súčasnou redukciou kardio-cerebrovaskulárnej morbidity a mortality, ostáva reziduálne KV-riziko stále vysoké. Je to vďaka nárastu obezity a s ňou súvisiaceho metabolického syndrómu a DM2T, pre ktoré je typická prítomnosť aterogénnej dyslipidémie. Zameranie sa na komplex aterogénnej dyslipidémie predstavuje rozšírenie terapeutických cieľov. Z existujúcich hypolipidemík by sme mali prehodnotiť efekt fibrátov v kombinačnej liečbe u pacientov s aterogénnou dyslipidémiou. Blízkou budúcnosťou sú selektívne PPARα modulátory, trochu vzdialenejšou budúcnosťou bude liečba zameraná priamo na metabolizmus lipoproteínov bohatých na triacylglyceroly. Tieto možnosti predstavujú novú príležitosť na redukciu KV-rizika ovplyvnením komplexu aterogénnej dyslipidémie.
MUDr. Fábryová Ľubomíra, PhD.
lfabryova@metabolklinik.sk
Metabol KLINIK s.r.o., ambulancia pre diabetológiu, poruchy látkovej premeny a výživy,
Bratislava
www.metabolklinik.cz
Doručené do redakcie 9. 8. 2016
Prijaté po recenzii 17. 9. 2016
Sources
1. Catapano AL, Reiner Z, De Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011; 217(1): 3–46.
2. Stone NJ, Robinson JG, Lichtenstein AH et al. [American College of Cardiology/American Heart Association Task Force on Practice Guidelines]. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014; 63(25 Pt B): 2889–2934. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2013.11.002>.
3. Piepoli MF, Hoes AW, Agewall S et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts): Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J 2016; 37(29): 2315–2381. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehw106>.
4. Mihaylova B, Emberson J, Blackwell L et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380(9841): 581–590.
5. Ridker PM. LDL cholesterol: controversies and future therapeutic directions. Lancet 2014; 384(9943): 607–617. <http://dx.doi.org/10.1016/S0140–6736(14)61009–6>.
6. Fruchart JC, Davignon J, Hermans MP et al. [Residual Risk Reduction Initiative (R3i)]. Residual macrovascular risk in 2013: what have we learned? Cardiovascular Diabetology 2014; 13 : 26. Dostupné z DOI: <http://dx.doi.org/10.1186/1475–2840–13–26>.
7. Catapano AL, Farnier M, Foody JM et al. Combination therapy in dyslipidemia: where are we now? Atherosclerosis 2014; 237(1): 319–35. Dostupné z DOI: <http://dx.doi.org710.1016/j.atherosclerosis.2014.09.026>.
8. Lloyd-Jones DM, Morris PB, Ballantyne CM et al. 2016 ACC Expert Consensus Decision Pathway on the Role of Non-Statin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk: A Report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2016; 68(1): 92–125. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2016.03.519>.
9. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after Acute Coronary Syndromes. N Engl J Med 2015; 372(25): 2387–2397. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1410489>.
10. Sabatine MS, Giugliano RP, Wiviott SD et al. [Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators]. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1500–1509. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1500858>.
11. Robinson JG, Farnier M, Krempf M et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1489–1499. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1501031>.
12. Fábryová Ľ. Diabetes a obezita. Editoriál. Forum Diab 2016; 5(1): 5–6.
13. Chapman MJ, Ginsberg HN, Amarenco P et al. [European Atherosclerosis Society Consensus Panel]. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: eveidence and guidance for management. Eur Heart J 2011; 32(11): 1345–1361. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr112>.
14. Halcox JP, Roy C, Henriksson KM. Assessing the Prevalence of Atherogenic Dyslipidemia in EURIKA Patients. Circulation 2015; 132(Suppl 3): A17096. Dostupné z DOI: <http://circ.ahajournals.org/content/132/Suppl_3/A17096>.
15. Mokáň M, Galajda P, Prídavková D et al. Prevalencia diabetes mellitus a metabolického syndrómu na Slovensku. Diabetes a obezita 2007; 12 : 2–10.
16. Fábryová Ľ. Rizikové faktory aterosklerózy v populácii novodiagnostikovaných diabetikov 2. typu. Dizertačná práca. Bratislava: 2007.
17. Klop B, Elte JWF, Cabezas MC. Dyslipidemia in Obesity: Mechanisms and Potential Targets. Nutrients 2013; 5(4): 1218–1240. Dostupné z DOI: <http://dx.doi.org/10.3390/nu5041218>.
18. Nordestgaard BG, Benn M, Schnohr P et al. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA 2007; 298(3): 299–308.
19. Freiberg JJ, Tybjærg-Hansen A, Jensen JS et al. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA 2008; 300(18): 2142–2152.
20. Di Angelantonio E, Sarwar N, Perry P et al. [Emerging Risk Factors Collaboration]. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302(18): 1993–2000.
21. Miller M, Cannon CP, Murphy SA et al. [PROVE IT-TIMI 22 Investigators]. Impact of triglyceride levels beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. J Am Coll Cardiol 2008; 51(7): 724–730. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2007.10.038>.
22. Faergeman O, Holme I, Fayyad R et al. [Steering Committees of IDEAL and TNT Trials]. Plasma triglycerides and cardiovascular events in the Treating to New Targets and Incremental Decrease in End-Points through Aggressive Lipid Lowering trials of statins in patients with coronary artery disease. Am J Cardiol 2009; 104(4): 459–463. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2009.04.008>.
23. Assmann G, Cullen P, Schulte H. Non-LDL-related dyslipidaemia and coronary risk: a case-control study. Diab Vasc Dis Res 2010; 7(3): 204–212. Dostupné z DOI: <http://dx.doi.org/10.1177/1479164110372640>.
24. Carey VJ, Bishop L, Laranjo N et al. Contribution of high plasma triglycerides and low high-density lipoprotein cholesterol to residual risk of coronary heart disease after establishment of low-density lipoprotein cholesterol control. Am J Cardiol 2010; 106(6): 757–763. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2010.05.002>.
25. Fruchart J Ch, Davignon J, Hermans MP et al. Residual macrovascular risk in 2013: what have we learned? Cardiovasc Diabetol 2014; 13 : 26. Dostupné z DOI: <http://dx.doi.org/10.1186/1475–2840–13–26>.
26. Varbo A, Benn M, Tybjærg-Hansen A et al. Remnant cholesterol as a causal risk factor for ischemic heart disease. J Am Coll Cardiol 2013; 61(4): 427–436. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2012.08.1026>.
27. Nordestgaard B, Varbo A. Lipids and cardiovascular disease 3: Triglycerides and cardiovascular disease. Lancet 2014; 384(9943): 626–635. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)61177–6>.
28. Rader DJ, Hovingh GK. Lipids and cardiovascular disease 2: HDL and cardiovascular disease. Lancet 2014; 384(9943): 618–625. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(14)61217–4>.
29. Rosenson RS, Davidson MH, Hirsh BJ et al. Genetics and causality of triglyceride-rich lipoproteins in atherosclerotic cardiovascular disease. J Am Coll Cardiol 2014; 64(23): 2525–2540. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2014.09.042>.
30. Xiao Ch, Dash S, Morgantini C et al. Pharmacological Targeting of the Atherogenic Dyslipidemia Complex: The Next Frontier in CVD Prevention Beyond Lowering LDL Cholesterol. Diabetes 2016; 65(7): 1767–1778. Dostupné z DOI: <http://dx.doi.org/10.2337/db16–0046>.
31. Austin MA, Breslow JL, Hennekens Ch et al. Low-density lipoprotein subclass patterns and the risk of myocardial infarction. JAMA 1988; 260(13): 1917–1921.
32. Miller M. The epidemiology of triglyceride as coronary artery disease risk factor. Clin Cardiol 1999; 22(6 Suppl): I1-I6.
33. Stavenow L, Kjellström T. Influence of serum triglyceride levels on the risk for myocardial infarction in 12510 middle aged males: interaction with serum cholesterol. Atherosclerosis 1999; 147(2): 243–247.
34. Bosomworth NJ. Approach to identifying and managing atherogenic dyslipidemia A metabolic consequence of obesity and diabetes. Canad Fam Physician 2013; 59(11): 1169–1180.
35. Dobiášová M. Atherogenic index of plasma: log(triglycerides/HDL-cholesterol). Theoretical and practical implications. Clin Chem 2004; 50(7): 1113–1115.
36. Dukát A, Fábryová Ľ, Oravec S et al. Lipidy a veľkosť lipoproteínových častíc u pacientov s novozisteným a doposiaľ neliečeným diabetes mellitus 2. typu. Vnitř Lék 2013; 59(6): 450–452.
37. Chapman MJ, Blankenberg S, Landmesser U. The year in cardiology 2015: prevention. Eur Heart J 2016 Feb; 37(6):510–519. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehv721>.
38. Wang D, Liu B, Tao W et al. Fibrates for secondary prevention of cardiovascular disease and stroke. Cochrane Database Syst Rev 2015; 25(10): CD009580. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD009580.pub2>.
39. Elam MB, Lovato LC, Ginsberg HN. The Effect of Combined Statin/Fibrate Therapy on Cardiovascular Disease is Influenced by Sex and Dyslipidemia: ACCORDION-Lipid Long-Term Follow-up. Circulation 2015; 132(Suppl 3): A15997. Dostupné z WWW: <http://circ.ahajournals.org/content/132/Suppl_3/A15997>.
40. Min J, Celine F, Jicheng LV et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet 2010; 375(9729): 1875–1884. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(10)60656–3>.
41. Sacks FM, Hermans MP, Fioretto P et al. Association between plasma triglycerides and high-density lipoprotein cholesterol and microvascular kidney disease and retinopathy in type 2 diabetes mellitus: a global case-control study in 13 countries. Circulation 2014; 129(9): 999–1008. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.113.002529>.
42. Hermans MP, Fruchart JC, Davignon J et al. Residual Microvascular Risk in Type 2 Diabetes in 2014: Is it Time for a Re - Think? A Perspective from the Residual Risk Reduction Initiative (R3i). J Diabetes Metab 2015; 5 : 413. Dostupné z DOI: <http://dx.doi.org/10.4172/2155–6156.1000413>.
43. Fruchart JC. Selective peroxisome proliferator-activated receptorα modulators (SPPARMα): The next generation of peroxisome proliferator-activated receptor α-agonists. Cardiovasc Diabetol 2013; 12 : 82. Dostupné z DOI: <http://dx.doi.org/10.1186/1475–2840–12–82>.
44. Taylor AJ, Villines TC, Stanek EJ et al. Extended-release niacin or ezetimibe and carotid intima-media thickness. N Engl J Med 2009; 361(22): 2113–2122. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0907569>.
45. Boden WE, Probstfield JL, Anderson T et al. [AIM-HIGH Investigators]. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011; 365(24): 2255–2267. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1107579>.
46. Landray MJ, Haynes R, Hopewell JC et al. [HPS2-THRIVE Collaborative Group]. Effects of extended-release niacin with laropiprant in high-risk patients. N Engl J Med 2014; 371(3): 203–212. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1300955>.
47. Barter PJ, Caulfield M, Eriksson M et al. [ILLUMINATE Investigators]. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med 2007; 357(21): 2109–2122.
48. Schwartz GG, Olsson AG, Abt M et al. [dal-OUTCOMES Investigators]. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N Engl J Med 2012; 367(22): 2089–2099. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1206797>.
49. Nicholls SJ, Lincoff A, Barter P et al. [Late-Breaking Clinical Trials II.] The ACCELERATE trial: impact of the cholesteryl ester transfer protein inhibitor evacetrapib on cardiovascular outcome. Presented at the 65th Annual Scientific Session and Expo of the American College of Cardiology. April 2–4, 2016; Chicago (IL).
50. Brinton EA, Kher U, Shah S et al. [DEFINE Investigators]. Effects of anacetrapib on plasma lipids in specific patient subgroups in the DEFINE (Determining the Efficacy and Tolerability of CETP INhibition with AnacEtrapib) trial. J Clin Lipidol 2015; 9(1): 65–71. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacl.2014.10.005>.
51. Robinson JG, Farnier M, Krempf M et al. [ODYSSEY LONGTERM Investigators]. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1489–1499. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1501031>.
52. Sabatine MS, Giugliano RP, Wiviott SD et al. [Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators]. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1500–1509. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1500858>.
53. Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk (FOURIER). ClinicalTrials.gov Identifier: NCT01764633. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT01764633>.
54. ODYSSEY Outcomes: Evaluation of Cardiovascular Outcomes After an Acute Coronary Syndrome During Treatment With Alirocumab SAR236553 (REGN727). ClinicalTrials.gov Identifier: NCT01663402. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT01663402>.
55. SPIRE-1: The Evaluation of Bococizumab (PF-04950615;RN316) in Reducing the Occurrence of Major Cardiovascular Events in High Risk Subjects. Clinical-Trials.gov Identifier: NCT01975376. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT01975376>.
56. SPIRE-2: The Evaluation of Bococizumab (PF-04950615; RN316) in Reducing the Occurrence of Major Cardiovascular Events in High Risk Subjects. Clinical - Trials.gov Identifier: NCT01975389. Dostupné z WWW: <https://clinicaltrials.gov/ct2/show/NCT01975389>.
57. Fábryová Ľ. Monoklonálne protilátky proti PCSK9 – nova nádej pre pacientov s vysokým kardiovaskulárnym rizikom. Interná Med 2014; 14(10): 408–416.
58. Druce I, Abujrad H, Ooi T Ch. PCSK9 and triglyceride-rich lipoprotein metabolism. J Biomed Res 2015; 29(6): 429–436. Dostupné z DOI: <http://dx.doi.org/10.7555/JBR.29.20150052>.
59. Crosby J, Peloso GM, Auer PL et al. TG and HDL Working Group of the Exome Sequencing Project, National Heart, Lung, and Blood Institute. Loss-off function mutations in APOC3, triglycerides, and coronary disease. N Engl J Med 2014; 371(1): 22–31. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1307095>.
60. Gaudet D, Alexander VJ, Baker BF et al. Antisense inhibition of apolipoprotein C-III in patients with hypertriglyceridemia. N Engl J Med 2015; 373(5): 438–447. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1400283>.
61. Wang Y, Gusarova V, Banfi S et al. Inactivation of ANGPTL3 reduces hepatic VLDL-triglyceride secretion. J Lipid Res 2015; 56(7): 1296–1307. Dostupné z DOI: <http://dx.doi.org/10.1194/jlr.M054882>.
62. Dijk W, Kersten S. Regulation of lipoprotein lipase by Angptl4. Trends Endocrinol Metab 2014; 25(3): 146–155. Dostupné z DOI: <http://dx.doi.org/10.1016/j.tem.2013.12.005>.
63. Cuchel M, Meagher EA, du Toit Theron H et al. Phase 3 HoFH Lomitapide Study investigators. Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study. Lancet 2013; 381(9860): 40–46. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)61731–0>.
64. Santos RD, Duell PB, East C et al. Long-term efficacy and safety of mipomersen in patients with familial hypercholesterolaemia: 2-year interim results of an open-label extension. Eur Heart J 2015; 36(9): 566–575. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht549>.
65. Meyers CD, Amer A, Majumdar T et al. Pharmacokinetics, pharmacodynamics, safety, and tolerability of pradigastat, a novel diacylglycerol acyltransferase 1 inhibitor in overweight or obese, but otherwise healthy human subjects. J Clin Pharmacol 2015; 55(9): 1031–1041. Dostupné z DOI: <http://dx.doi.org/10.1002/jcph.509>.
66. Griffith DA, Kung DW, Esler WP et al. Decreasing the rate of metabolic ketone reduction in the discovery of a clinical acetyl-CoA carboxylase inhibitor for the treatment of diabetes. J Med Chem 2014; 57(24): 10512–10526. Dostupné z DOI: <http://dx.doi.org/10.1021/jm5016022>.
67. Pinkosky SL, Filippov S, Srivastava RA et al. AMP-activated protein kinase and ATP-citrate lyase are two distinct molecular targets for ETC-1002, a novel small molecule regulator of lipid and carbohydrate metabolism. J Lipid Res 2013; 54(1): 134–151. Dostupné z DOI: <http://dx.doi.org/10.1194/jlr.M030528>.
68. Fábryová Ľ. Antiaterogénny efekt inkretínov: fakt alebo fikcia? Interná Med 2014; 14(2): 77–82.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adultsArticle was published in
Athero Review

2016 Issue 3
-
All articles in this issue
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Periférne artériové ochorenie dolných končatín a dyslipidémia
- Význam mikroRNA v patofyziologii aterosklerózy a jejich možné klinické využití
- Inhibítory proproteín konvertázy subtilizín/kexín typ 9 (PCSK9)
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Vysoká prevalence kardiovaskulárních rizikových faktorů a neuspokojivá kontrola hladin LDL-cholesterolu v populaci 40letých mužů a 50letých žen v České republice
- Je možné zlepšiť primárnu prevenciu ischemickej choroby srdca? A akým spôsobom?
- Od dyslipidemie k ischemické chorobě srdeční a zpět
- Athero Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Periférne artériové ochorenie dolných končatín a dyslipidémia
